标准状况下,向100mLFeCl3溶液中通入a L的H2S气体恰好完全反应后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为( )
| A.1 mol/ L | B.1.5mol/L | C.2 mol/L | D.以上答案均不正确 |
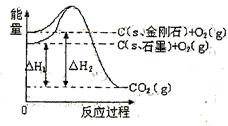
如图所示,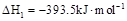 ,
,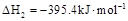 ,
,
下列说法或表示正确的是
A.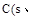 石墨)= 石墨)=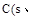 金刚石)△H=+1.9 金刚石)△H=+1.9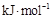 |
| B.石墨和金刚石的转化是物理变化 |
| C.石墨的稳定性比金刚石弱 |
D.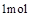 石墨的总键能比1mol金刚石的总键能小1.9kJ 石墨的总键能比1mol金刚石的总键能小1.9kJ |
X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y:X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y的离子。则这四种金属的活动性由强到弱的顺序为
| A.X>Y>Z>M | B.X>Z>M>Y | C.M>Z>X>Y | D.X>Z>Y>M |
A、B、C、D、E是5种短周期元素,其原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是次外层电子数的3倍,C、D、E处于同一周期,E与B处于同一族,C、D原子的核外电子数之和与B、E原子的核外电子数之和相等。下列说法正确的是
A.元素B、C、D具有相同电子层结构的离子,其半径依次增大
B.元素A不能与元素B形成化合物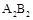
C.元素B、E分别与元素A形成的化合物的热稳定性: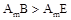
D.元素D、E的最高价氧化物的水化物都是强酸
①①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是
| A.①②③均是氧化还原反应 |
B.氧化性强弱顺序是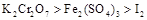 |
| C.反应②中氧化剂与还原剂的物质的量之比为6:1 |
D.反应③中0.1mol还原剂共失去电子数为 |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al |