(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)= ;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)= 。
(2)在CH3COONa的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)明矾的水溶液显酸性,其原因是(用离子方程式表示) 。
(4)在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(5)1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 。
(6)已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4与NO2与完全反应生成氮气和气态水的热化学方程式为 。
在下列物质中:NaCI、NaOH、Na2O2、H2O2、(NH4)2S、CCI4、C2H2、SiC、晶体硅、金刚石、SO3
①其中只含有离子键的离子晶体是 ;
②其中既有离子键,又有极性键和配位键的离子晶体是 ;
③其中既有离子键,又有非极性键的是 ;
④其中含有非极性键的非极性分子的是 ;
⑤其中含非极性键的极性分子的是 ;
⑥其中含有极性键的的原子晶体是 ;
已知下列热化学方程式:
①H2O(l)=H2(g)+1/2O2(g)△H1=+285.8kJ/mol
②H2(g)+1/2O2(g)=H2O(g)△H2=-241.8kJ/mol
③C(s)+1/2O2(g)=CO(g)△H3=-110.5kJ/mol
④C(s)+O2(g)=CO2(g)△H4=-393.5kJ/mol
回答下列问题:
(1)C的燃烧热为
(2)燃烧10gH2生成液态水,放出的热量为
(3)写出CO燃烧的热化学方程式
(4)写出制水煤气的热化学方程式
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。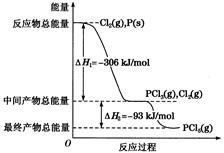
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_______________________
(2)PCl5分解成PCl3和Cl2的热化学方程式是_______________________
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________,P和Cl2一步反应生成1 mol PCl5的ΔH4_____________ΔH3(填“大于”、“小于”或“等于”)。
(1)CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ/mol) |
414.4 |
615.3 |
347.4 |
435.3 |
计算该反应的反应热 (写出计算过程)
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)△H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g)ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ/mol
试计算1 mol肼和二氧化氮完全反应时放出的热量为__________________kJ,写出肼与二氧化氮反应的热化学方程式:______________________
如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题: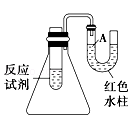
(1)将铝片加入小试管内,然后注入足量稀盐酸,有关反应的离子方程式是 ,试管中观察到的现象是
(2)U形导管中液面A (填“上升”或“下降”),原因是 ,说明此反应是 (填“吸热”或“放热”)反应。