【化学——化学与技术】火山喷发所产生的硫磺可用于生产重要的化工原料——硫酸。某企业用下图所示的工艺流程生产硫酸:
请回答下列问题:
(1)①为充分利用反应放出的热量,转化器中应安装______(填设备名称)。吸收塔中填充有许多瓷管,其作用是________;
②为使硫磺充分燃烧,经流量计l通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为转化器中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计l和流量计2的空气体积比应为______。b管排出的尾气的处理方法是________.
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是_________(填字母序号)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛;其中可应用于下列哪些方面__________(填字母序号)。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式___________________________
(11分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题: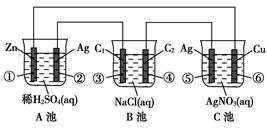
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
(11分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: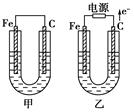
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,该池中溶液体积是200 mL,则溶液混匀后的pH=________。
(6分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
(12分)Ⅰ.(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 ________(填“促进”、“抑制”)其水解。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。
Ⅱ. 已知水在25 ℃(A)和T ℃(B)时,其电离平衡曲线如图所示: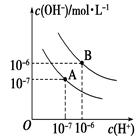
(1)25 ℃时,将pH=3 的H2SO4溶液与pH=10的NaOH溶液混合,若所得混合溶液的pH=7,则H2SO4溶液与NaOH溶液的体积比为。
(2)T ℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强Ⅰ碱的pH2之间应满足的关系是。
(3)曲线B对应温度下,pH=3的HCl溶液和pH=9的某碱溶液等体积混合后,混合溶液的pH>7。请分析其原因:。
(1)甲烷通常用来作燃料,其燃烧反应的化学方程式是。
(2) 若用甲烷—氧气构成燃料电池,电解质溶液为KOH溶液,试写出该电池的正极的电极反应式;负极的电极反应式。