(10分) 现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B 、丙
(2)写出下列反应的化学方程式:
反应① ;反应③ ;
反应⑥ 。
(8分)(1)按系统命名法填写下列有机物的名称:
CH3CHC2H5CHCH3(CH2)3CH3的名称是________。
(2)2,6二甲基4乙基辛烷的结构简式是________,1 mol该烃完全燃烧需要消耗氧气________mol。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为________。
②有n对共用电子对的单烯烃的分子式为________。
(4)如图是由4个碳原子结合成的6种有机物(氢原子没有画出)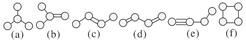
①写出有机物(a)的系统命名法的名称________。
②有机物(a)有一种同分异构体,试写出其结构简式
________________________________________________________________________。
③上述有机物中与(c)互为同分异构体的是________(填代号)。
④与(e)互为同系物的最简单有机物的结构简式为:
________________________________________________________________________。
⑤上述有机物中不能与溴水反应使其褪色的有________(填代号)。
⑥(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有________(填代号)。
(8分)已知:A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=________。酸碱按体积比为1 ∶10混合后溶液显中性,则a+b=________。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为________mol·L-1,B溶液中水电离出的氢离子浓度为________mol·L-1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系为VA________VB(填“>”、“<”或“=”,下同),混合后溶液中的离子浓度关系为c(Na+)________
c(CH3COO-)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
将水煤气化转化成合成气,然后合成各种油品和石化产品是化工的极为重要的领域。除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为;
②下列能增大碳的转化率的措施是;
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
 CH4(g)+3/2O2(g) CO(g)+2H2O(g)△H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CH4(g)+3/2O2(g) CO(g)+2H2O(g)△H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知根据上述信息,你认为在生产中应该选择的适宜催化剂是(填“X”或“Y”或“Z”),选择的理由是;
(3)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下: 2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
2H2(g)+CO(g) CH3OHg); △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
①该时间段内反应速率v(H2)=mol-1·L-1·min-1。
②比较此时正、逆反应速率的大小:
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化方程式是 。
。
(2)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的 KOH溶液。
肼—空气燃料电池放电时:
正极的电极反应式是。
负极的电极反应式是
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是。
②假设使用肼一空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气L(假设空气中氧气体积含量为20%)