除去括号内杂质所用试剂和方法,正确的是
| A.乙醇(乙酸)、 KOH溶液 、分液 |
| B.乙烯(SO2) 、 KMnO4溶液 、洗气 |
| C.乙烷(乙烯)、 H2(催化剂)、催化加氢 |
| D.乙醇(水)、 CaO 、蒸馏 |
下列说法不正确的是
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g) ΔH=-297.23kJ·mol-1,分析下列说法中不正确的是
| A.S的燃烧热为297.23kJ·mol-1 |
| B.S(g)+O2(g)=SO2(g)放出热量大于297.23kJ |
| C.S(g)+O2(g)=SO2(g)放出热量小于297.23kJ |
| D.形成1molSO2(g)的化学键释放的总能量大于断裂1molS(s)和1molO2(g)的化学键吸收的总能量 |
下列叙述中正确的是
| A.在稀溶液中,1mol酸和1mol碱完全反应所放出的热量,叫做中和热 |
| B.热化学方程式中,各物质前的化学计量数不表示分子个数 |
| C.在101kPa时,1mol物质燃烧时所放出的热量叫做该物质的燃烧热 |
| D.如果反应物所具有的总能量小于生成物所具有的总能量,则反应放热 |
已知某可逆反应mA(g)+nB(g) xC(g)在密闭容器中进行,右图表示反应在不同时间t、温度T和压强p与C在混合气体中的百分含量(C%)的关系曲线,则正确的是
xC(g)在密闭容器中进行,右图表示反应在不同时间t、温度T和压强p与C在混合气体中的百分含量(C%)的关系曲线,则正确的是
| A.T1>T2,p1>p2,m+n>x,正反应放热 |
| B.T1<T2,p1<p2,m+n<x,正反应吸热 |
| C.T1>T2,p1<p2,m+n<x,正反应放热 |
| D.T1<T2,p1>p2,m+n>x,正反应吸热 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) 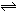 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是
| A.若T2>T1,达到平衡时b、d点的反应速率为vd>vb |
| B.若T2>T1,则正反应一定是放热反应 |
| C.达到平衡时A2的转化率大小为b>a>c |
| D.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a |