将1.52 g的铜镁合金完全溶解于50mL14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加人1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.若该浓硝酸的密度为1.40g/mL则该浓硝酸的溶质质量分数为63% |
| B.该合金中铜与镁的物质的最之比是2:1 |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加人NaOH溶液的体积是620 mL |
Ⅰ.下列实验操作或对实验事实的叙述正确的是__________(填序号)。
①向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
②一小块金属钠加入水中后迅速熔成小球,不停地在水面游动并发出“嘶嘶”的响声;
③配制100 mL 1.00 mol·L-1的NaCl溶液时,可用托盘天平称取5.85 g NaCl固体;
④向可能含有 ,
,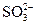 的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验
的溶液中加入过量的盐酸,再加入Ba(NO3)2溶液,可检验 的存在;
的存在;
⑤蒸发NaCl溶液,当得到较多NaCl固体时,就停止加热,利用余热蒸干;
⑥向AlCl3溶液中滴加NaOH溶液和向NaOH溶液中滴加AlCl3溶液的现象相同。
Ⅱ.(1)若实验需用6 mol·L-1的盐酸250 mL,配制时除需用量筒、烧杯、玻璃棒外,还需用的仪器有:__________、__________。
(2)实验室利用向氨化后的饱和NaCl溶液中通入过量的CO2来制备NaHCO3晶体,为了分离出NaHCO3晶体,必须用到右图中__________(填序号)装置。
(3)写出生成NaHCO3的化学方程式:______________________________。
对比实验是研究物质性质的一种重要方法,下列不是用来做对比实验的是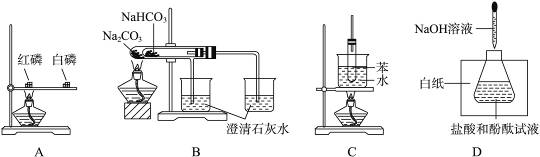
某学习小组做电浮选凝聚法净化污水的实验时,同学们发表了如下看法,其中错误的是
| A.两个电极都可选用Fe片 |
| B.电源电极接反时仍能产生一定净水效果 |
| C.反应中产生的H2会将Fe3+还原成Fe2+ |
| D.电浮选凝聚法用于工业污水处理时要注意通风,防止爆炸 |
由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是
A.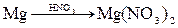 |
B.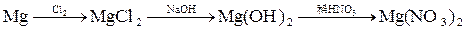 |
C. |
D.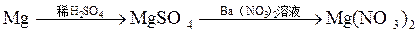 |
研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是
| A.铜与浓硫酸反应后所得的白色固体是CuSO4 |
| B.加BaCl2溶液后生成的白色沉淀是BaSO3 |
| C.白色固体中夹杂的少量黑色物质可能是CuO |
| D.白色固体中夹杂的少量黑色物质中含元素Cu、S,一定是CuS |