(10分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
 族 族周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
|
|
|
① |
② |
③ |
④ |
|
| 三 |
⑤ |
⑥ |
⑦ |
|
|
⑧ |
⑨ |
⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为_____>_____>____ (填元素符号),判断的实验依据是_______(写出一种)。
A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量不变,完全燃烧后所产生的CO2的质量就不变。
(1)试写出两组符合上述情况的烃的结构简式:
________________和________________;
________________和________________。(与第一组的物质类别不同)
(2)A、B应满足的条件是_____________________________________________。
(每空2分,共10分)有A、B、C三种有机物,结构简式如下图所示,试回答有关问题: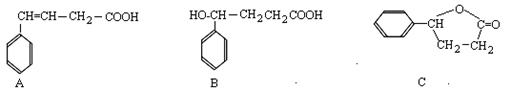
(1)A与C的关系为 。
(2)A→B的反应类型为 。
(3)B→C的化学方程式为 。
(4)1mol A与足量H2发生反应,最多消耗 mol H2;A经加聚反应所得聚合物的结构简式为 。
【原创】现有A、B、C、D、E五种金属片,①把A、C用导线连接后同时浸入稀硫酸铜溶液中,A上有红色固体产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生氧化反应;③把A、B 用导线连接后同时浸入稀硫酸溶液中,电流方向为B→导线→A;④将E放入水中,立即有气体产生。根据上述情况,回答下列问题:
(1)在①中,金属片_______发生氧化反应;
(2)在②中,金属片_______作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片_______上有气泡产生;
(4)上述五种金属的活动性顺序是__________________。
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式_________________________________________。
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;
负极反应:________________________;
电解质溶液pH的变化_______.(填“增大”“减小”或“不变”.下同)
(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。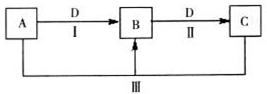
请按要求回答下列问题:
(1)若B、D为短周期同一主族的非金属单质,则反应(III)中氧化产物与还原产物的物质的量之比为___。
(2)若A、B、C均为短周期元素组成的化合物,且溶液都显碱性,D为植物光合作用必须吸收的气体,物质A中化学键的类型为________________,相同温度下的溶解度B___________C(填“大于、小于、等于”)。
(3)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则检验B溶液中阳离子的试剂为_________;C的溶液保存时,常加入D的目的是__________________。
(4)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,写出反应(III)的离子方程式是_______________________________;符合条件的D物质可能是_______________(填序号)。
①硫酸 ②碳酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡