现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式_________________________________________。
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;
负极反应:________________________;
电解质溶液pH的变化_______.(填“增大”“减小”或“不变”.下同)
元素W、X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;X元素的最高正价与最低负价绝对值之差为2;N-、Z+、W+的半径逐渐减小;化合物WN常温下为气体,据此回答下列问题:
(1)W与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_________________________________________。
(2)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:_________________。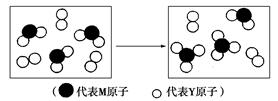
(3)A、B均为由上述六种元素中的三种元素组成的强电解质,且组成元素的原子个数之比均为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的电子式是________。
(4)XY2与H2O反应的离子方程式为__________________________________。
如图是从元素周期表中截取的一个片断,其中X、Y、Z、W均属于短周期元素。请回答下列问题。
(1)若X单质为空气中的主要成分之一,则W的原子结构示意图为________。
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,这三种酸的正盐的含氧酸根离子中,有两种的电子数相等,这两种离子的离子符号是________、________。
(3)若Na与Y和Z的单质分别反应可以生成摩尔质量相同的两种化合物,其中Na与Y形成的化合物的电子式为________,所含化学键的类型为________。
(4)Y元素在元素周期表中处于第________纵行(写出所有可能纵行数)。
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
| 物质 |
甲 |
乙 |
CO |
H2 |
| 燃烧热/(kJ·mol-1) |
1 366 |
5 518 |
283 |
286 |

取甲、乙按不同比例混合的燃油23 g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
(1)乙的相对分子质量Mr(乙)=________。
(2)160 g由甲、乙以等物质的量混合而成的燃油在347.2 L O2中恰好完全燃烧,得492.8 L气体,冷却到室温时,还剩余224 L(气体体积均在标准状况下测定)。由此可求得混合物中,C、H、O的原子个数比为________。甲、乙的分子式为:甲________;乙________。
(3)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2 876 kJ,则反应中生成CO________mol。
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)
ΔH=a kJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g)ΔH=b kJ·mol-1
(1)反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
(2)Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______________________________________。
能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。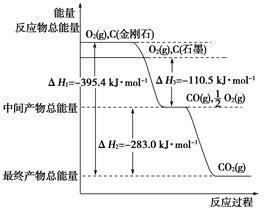
①在通常状况下,金刚石和石墨中________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)=2NO(g) ΔH=180.0 kJ·mol-1。
NO分子中化学键的键能为________kJ·mol-1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式_________________________________。