下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
 族 族周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
|
|
|
① |
② |
③ |
④ |
|
| 三 |
⑤ |
⑥ |
⑦ |
|
|
⑧ |
⑨ |
⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是_______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______ (填元素符号),判断的实验依据是________________________________________________(写出一种)。
某有机物A,由C、H、O三种元素组成,在一定条件下由A可以转变为有机物B、C、D、E。转变关系如下: (已知 R—CH2—CH2 OH
(已知 R—CH2—CH2 OH R—CH CH2 +H2O)
R—CH CH2 +H2O)
已知B是石油化工发展水平的标志
(1)写出A、B、C、D、E、F的结构简式
AC
DF
(2)写出实现下列转化的化学方程式,并注明反应类型
A~ B
B~ C
A~ D
A+E~ F
(10分) A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A;B; C。
(2)一段时间后,B中Sn(锡)极附近溶液的pH(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为mol·L-1。
(8分)已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 ___(填“>”、“<”或“=”)570 kJ
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。该电池的正极为:__________(填A或B)。若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为 ____________ mol 。
(3)写出电极反应式A:; B:;
(共9分)(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;5.4 g D的单质跟足量盐酸反应,生成D3+和6.72 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
①写出元素符号:
A,C,E。
②B、D的最高价氧化物对应水化物相互反应的离子方程式为:
③用电子式表示C与E形成E2C的过程:。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。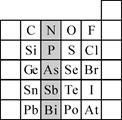
①根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
②元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
 芳香化合物A、B互为同分异构体,B的结构简式是 CH3COO--COOCH2CH3 ,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
芳香化合物A、B互为同分异构体,B的结构简式是 CH3COO--COOCH2CH3 ,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
(1)B可以发生的反应类型有(填序号)_______________.
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
B的核磁共振氢谱中会出现_______个峰.
(2)E中含有官能团的名称是__________________.
(3)A有两种可能的结构,其对应的结构简式为________________、______________.
(4)B、C、D、F、G化合物中互为同系物的是_________________.
(5)F与H在浓硫酸作用下加热时发生反应的方程式为_________________________.