(8分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_______________________________。
(2)流程乙加入烧碱后生成SiO 的离子方程式为___________________________。
的离子方程式为___________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入__________________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是_____(填化学式),写出该溶质的一种用途________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。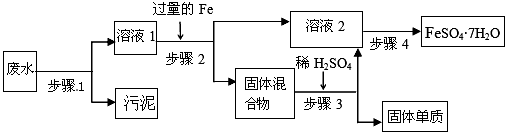
(1)步骤1的主要操作是__________,需用到的玻璃仪器除烧杯外有________,________。
(2)步骤2中发生反应的离子方程式为___________________________
(3)步骤3中发生反应的化学方程式为___________________________
(4)步骤4中涉及的操作是:蒸发浓缩、_________、过滤、洗涤、烘干。
氮元素的单质和常见的化合物在工、农业生产中用途广泛.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
| N2 |
O2 |
Ar |
CO2 |
| -196℃ |
-183℃ |
-186℃ |
-78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g.
(4)已知:4NH3+6NO 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
(1)A的化学式是______
(2)F在空气中转化为G的化学方程式:________________________
(3)C转化为I的离子方程式:__________________________
(4)J转化为C的化学方程式:________________________
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
①向该待测液中加入过量的稀盐酸,有白色沉淀生成。
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)待测液中一定含有离子,一定不含有离子。
(2)还有一种离子无法确定是否存在,检验该离子实验方法的名称是观察到的现象是 。
置换反应的通式可表示为: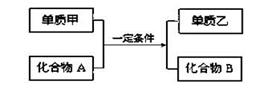
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若A为两种元素形成常温下呈液态的化合物,化合物B的焰色反应呈黄色,则该反应的化学方程式为:。
(2)若甲是一种金属单质,在高温条件下,本反应常用于焊接钢轨。则该反应的化学方程式为:。
(3)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应的化学方程式为:。