(8分)在 1.0L恒容密闭容器中放入0.10 mol A (g),在一定温度进行如下反应。
A(g) 2B(g) + C(g) + D(s) △H =" +" 85.1 kJ / mol
2B(g) + C(g) + D(s) △H =" +" 85.1 kJ / mol
容器内气体总压强(P)与起始压强P。的比值随反应时间(t)变化数据见下表(提示:密闭容器中的压强比等于气体物质的量之比)。
回答下列问题:
(1)下列能提高 A 的转化率的是 。
A.升高温度 B.向体系中通人A气体
C.减少D的物质的量 D.向体系中通人稀有气体He
(2)平衡时A的转化率为 (保留两位有效数字)。
(3)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则 D 的取值范围 n (D) mol 。
(4)将容器改为恒压容器,改变条件,使反应达到相同的限度,则达到平衡时 B 的浓度为
相对分子质量不超过100的有机物A能与碳酸钠反应产生无色气体;1 mol A还可以使含溴160 g 的四氯化碳溶液恰好褪为无色;A完全燃烧只生成CO2和H2O;经分析其含氧元素的质量分数为37.21%。
(1)试写出A中含有的官能团的名称:_______________________。
(2)经核磁共振检测发现A的图谱如下:
①写出A的结构简式:。
② A具有下列性质中的(选填字母)_____________:
a.能使酸性高锰酸钾溶液褪色 b.能使溴水褪色
c.能与乙醇和浓硫酸混合液发生反应 d.能与金属钠反应
③ A在一定条件下可以发生聚合反应生成高分子化合物,写出反应的方程式:
(3)相对分子质量与A相同的某烃C有多种同分异构体,请写出其中核磁共振氢谱中峰面
积比最大的C的结构简式:。
有A、B、C、D、E、F六种元素。A是宇宙中最丰富的元素;B是周期表中电负性数值最大的元素;C的基态原子中2p轨道有三个未成对的单电子;F原子核外电子数是B与C核外电子数之和;D是主族元素,且与副族元素E同周期;E能分别形成红色(或砖红色)的E2O和黑色的EO两种氧化 物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。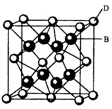
(1)E元素原子基态时的外围电子排布式为。
(2)A2F分子中F原子的杂化类型是,F的气态氧化物FO3分子的键角为。
(3)CA3极易溶于水,其原因是,试判断CA3溶于水后,形成CA3·H2O的最合理结构为(选填字母)。
(4)从晶胞结构图中可以看出,D跟B形成的离子化合物的电子式为;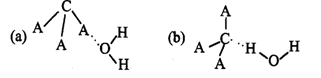
该离子化合物晶体的密度为ρ(g·cm-3)。,则晶胞的体积是(只要求列出算式)。
北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。请回答下列问题: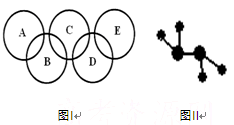
(1)火焰利用了部分金属的______反应,该反应属于______(填“物理”或“化学”)变化。
(2)右图Ⅰ所示的五圆环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素。 A是沼气的主要成分;B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型如图Ⅱ;C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
A是沼气的主要成分;B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型如图Ⅱ;C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为,D的化学式是。
② A、B、E中均含有的一种元素为(填元素名称)。
③NH3分子中的N原子有一对孤对电子,能发生反应:NH3 + HCl = NH4Cl。试写出E与足量盐酸发生反应的化学方程式。
(3)我国科研人员在实验室应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似。已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60分子的结构中含有_________个N—N键。
已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子只有一个质子;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;Y原子的最外层电子数是内层电子数的2倍。
(1)写出下列字母所代表元素的名称:X;Y;Z;W。
(2)X单质和Z单质在一定条件下反应生成化合物E,写出该反应的化学方程式(并注明反应条件);Y单质和W单质(足量)在加热条件下反应生成化合物F,则F分子的空间构型为,电子式为。
(3)这四种元素可组成X、Y、Z、W原子个数比为5∶1∶1∶3的化合物,该化合物的水溶液与足量浓NaOH溶液反应的离子方程式为:
___________________________________________________________________
氰[(CN)2]为无色可燃气体、剧毒、有苦杏仁味,是拟卤素的一种。拟卤素的性质与卤素相似。
(1)写出氰与苛性钠溶液反应的化学方程式:。
(2)已知氰分子中键角为180°,分子具有对称性,(CN)2的结构式为,(CN)2的分子为(填“极性”或“非极性”)分子。
(3)CN-中电子数为。