室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4 (s) +5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4 (s) +5H2O(l),热效应为ΔH3。则下列判断正确的是
| A.ΔH2>ΔH3 | B.ΔH1<ΔH3 | C.ΔH1+ΔH3=ΔH2 | D.ΔH1+ΔH2=ΔH3 |
用惰性电极电解1 L 0.1 mol·L-1含Cu2+、X3+的水溶液,阴极质量的增重与通过电子的物质的量关系如图4-15所示,则溶液中离子的氧化性由强到弱的顺序是(X3+无可变价态)( )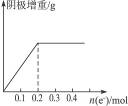
图4-15通过电子的物质的量
| A.Cu2+>X3+>H+ | B.X3+>Cu2+>H+ |
| C.Cu2+>H+>X3+ | D.H+>Cu2+>X3+ |
X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y。X和Z组成原电池时,Z为正极。Y和Z两种离子在同一溶液中被电解时,阴极只能得到Y单质,M离子的氧化性强于Y离子,则这四种金属的活动性由强到弱的顺序是( )
| A.XYZM | B.XZMY | C.MZXY | D.XZYM |
电解某盐溶液时在阴、阳两极上相等的是( )
| A.析出金属的物质的量 | B.析出金属的质量 |
| C.转移的电子数目 | D.放出气体的体积 |
用直流电电解下列各溶液一段时间后,溶液的颜色和密度保持不变的是
| A.用铜电极电解CuCl2溶液 |
| B.用石墨电极电解Na2SO4溶液 |
| C.用铜电极电解稀H2SO4 |
| D.锌为阳极,铁为阴极,电解ZnCl2溶液 |
下列叙述正确的是( )
| A.铜锌原电池工作一段时间后,铜的质量增加 |
| B.钢铁的吸氧腐蚀负极反应为:Fe-2e====Fe2+ |
| C.电解AlCl3溶液可得到Al |
| D.电镀时应把镀件置于电解池的阳极 |