(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶 液。
肼—空气燃料电池放电时:正极的电极反应式是 。
负极的电极反应式是 。
(3)下图是一个电化学过程示意图。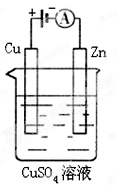
①锌片上发生的电极反应是 。
②假设使用肼 空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼 空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方
程式是 。
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是_________________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。
下表列出了A~R十种元素在周期表中的位置:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
E |
R |
F |
||||
| 3 |
A |
C |
D |
H |
I |
G |
|
| 4 |
B |
请回答下列问题:
(1)写出R单质分子的电子式________。
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是________(填化学式)。
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为________(用元素的离子符号表示)。
(4)写出A的单质与水反应的化学方程式_____________________________。
(5)X元素是A~R十种元素中的一种,X的原子核里有14个中子,2.7 g X在氧气里燃烧时,质量增加2.4 g。X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应。X的元素符号是________,它位于元素周期表中第________周期第________族。
已知A、B、C、D分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒。请回答下列问题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程式:_________________________________________________________________。
(2)若B、D属于同主族元素形成的单质分子,写出C的化学式:________。
(3)若A、B均是含有2个原子核的微粒,且B中含有10个电子,D中含有18个电子,则A、B之间发生反应的离子方程式为___________________________________________________。
(4)若D是一种含有22电子的分子,则符合如图所示转化关系的A为________________(写出物质的化学式,如果是有机物则写出相应的结构简式)。
A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-、SO42-、CO32-两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管。
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解
C溶液 白色沉淀
白色沉淀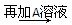 沉淀不溶解
沉淀不溶解
D溶液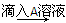 白色沉淀
白色沉淀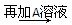 沉淀部分溶解
沉淀部分溶解
③向B溶液中滴入D溶液,无明显实验现象。
请回答下列问题:
(1)写出它们的化学式:A________;B________;C________;D________;
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式为_________________________________________________________________。
(3)③中若向C溶液中滴入D溶液,可能出现的实验现象是_________________________________________________________________。
用离子方程式表示其原因:_________________________________________。
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
________KBrO3+________+________H2SO4―→……;
③若转移10 mol电子,则反应后生成I2的物质的量为________。