按要求书写热化学方程式:
① 1molN2(g)与适量H2(g)起反应生成NH3(g),放出92.2 kJ热量:
② 稀盐酸和稀NaOH溶液混合的热化学方程式:
③2 gH2完全燃烧生成液态水放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为:
④ 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:
把等物质的量的Cu、Fe粉投入一定量的FeCl3溶液中充分反应后取出部分溶液,
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有_________。
(2)若加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有_________,可能存在的金属粉末有_________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+):n(Fe2+)是_________。
(4)若(3)反应后的溶液中有3种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)___________________________________。
某研究性学习小组用FeCl3溶液做“腐蚀液”,制作印刷电路板,其反应原理是:2FeCl3+Cu=2FeCl2+CuCl2。
【实验探究】
(1)通过《化学1》的学习,知道了有离子参加的化学反应为离子反应。离子反应可用离子方程式表示。请写出2FeCl3+Cu=2FeCl2+CuCl2反应的离子方程式为:。
(2)若要溶解电路板上3.2g的铜,则至少需要FeCl3物质的量为mol。
(3)使用后失效的“腐蚀液”为废液,验证废液中是否存在Fe3+的试剂是,加入该试剂后,若出现现象,说明废液中还存在Fe3+。
(4)废液中的CuCl2可通过加入足量的,反应后转化成铜且能使所得溶液中含有单一溶质。
(5)回收Cu后的废液,通入足量的Cl2,可以重新获得FeCl3溶液,其反应的化学方程式为。
【实验结论】
利用FeCl3溶液做印刷电路板的“腐蚀液”,不仅废液中的铜可以得到回收,经过处理后的废液还可以重新使用。
【知识拓展】
(6)铁元素是维持生命活动不可缺少的微量元素,虽然人体中通常只含有3~5g铁元素,但铁元素在人体中却发挥着重要作用,人体缺铁会引起疾病。
某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝,流程如下,回答下列问题: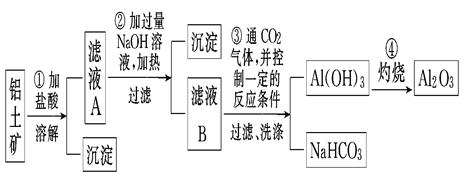
(1)画出Al的原子结构示意图。
(2)写出反应①中主要成分发生反应的化学方程式:。
(3)写出滤液B中溶质的化学式。
(4)甲同学在实验室中用如左下图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。乙同学分析认为:甲同学通入的CO2中含有HCl气体,是导致实验失败的原因。乙同学认为在实验装置Ⅰ和装置Ⅱ之间增加右下图装置可解决这个问题。请在右下图装置的横线上注明试剂名称。
(5)工业上通常以铝土矿提取得到的Al2O3为原料制备无水氯化铝:
该反应中的还原剂是,若制得22.4 L(标准状况下)CO2气体时,则有mol电子发生转移。
海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。
按要求回答问题:
(1)浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,可供提取利用的有50多种。下列物质不需要通过化学变化就能够从海水中获得的是。
A.食盐B.金属钠C.淡水
(2)以电解食盐水为基础制取Cl2、等产品的工业称为“氯碱工业”。
(3)实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气
MnCl2+Cl2↑+2H2O;根据上述实验原理,从下列装置中选择合适的发生装置用于实验室制取少量氯气
(填写装置的序号)。
(4)实验室中模拟Br—→Br2的转化,可以通过在KBr溶液中滴加少量新制氯水的实验进行实现。写出Br—→Br2的转化离子方程式为:;氯水不稳定,要现用现配,下列吸收氯气制备氯水的装置最合理的是(选填下列选项的编号字母)。
(5)电解熔融氯化镁所得的镁蒸气冷却后即为固体镁。下列气体中,镁蒸气可以在其氛围中冷却的是 (选填下列选项的编号字母)。
A.Cl2 B.N2 C.Ar D.空气 E.H2
实验是化学研究的一种重要手段,现有下图所示A~G七种仪器,请根据要求填空。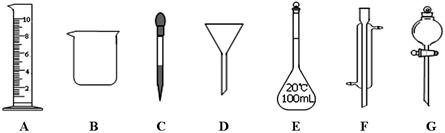
(1)写出仪器名称:B,F
(2)下列实验操作中用到仪器G的是(选填下列选项的编号字母)。
a.分离水和CC14的混合物 b.分离水和酒精的混合物 c.分离水和泥砂的混合物
(3)实验室配制100mL 0.5mol/L的盐酸溶液。
①下列关于仪器E的使用方法中,正确的是(选填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到容量瓶中
②需用10mol/L的浓盐酸mL。取用该体积盐酸时,需要用到上述仪器中的A和(选填仪器的编号字母)。
③在实验时,按下列步骤“计算→量取→溶解→转移→定容→保存到试剂瓶中”进行配制,定容后,液面位置(如下左图)正确的是(选填下列选项的编号字母)。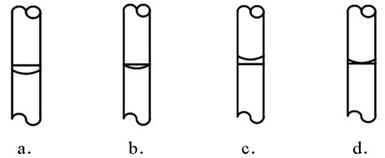

④请在试剂瓶标签上填写相应内容(盛放上述配制好的溶液)[(标签如上右图)]。