有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:Cu2O + 2H+ =" Cu" + Cu2+ + H2O;
部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
1.8 |
6.3 |
5.2 |
| 完全沉淀的pH |
3.0 |
8.3 |
6.7 |
注:金属离子的起始浓度为0.1 mol·L-1 实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为 。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 。
(3)溶液C中除H+、Cu2+外一定还含有另一种阳离子;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是 。
(4)Ⅳ中加NaClO的目的是 。
(5)将Ⅳ中得到的溶液D电解,若电路中有0.1mol电子通过,则理论上阴极质量增重 g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合1: ;组合2:
;……(用化学式表示)
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上的电子数是原子核外电子层数的2倍 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
完成下列问题:
(1)元素T在周期表中位于第______周期第______族.
(2)元素X的一种同位素可测定文物年代,其原子核内有8个中子,这种同位素的符号是________.
(3)元素Y与氢元素形成一种分子YH3,写出该粒子的电子式____________.
(4)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一结果的是________________________________.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应
(5)T、X、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是________________(用化学式表示).
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转化关系如图所示: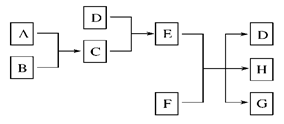
(1)D的化学式(分子式)是________,E的化学式(分子式)是__________________。
(2)A和B反应生成C的化学方程式是______________________________。
(3)E和F反应生成D、H和G的化学方程式是_____________________________。
在浓硝酸中放入铜片:
(1)开始反应的化学方程式为_________________。
(2)若铜有剩余,则反应将要结束时的反应化学方程式是______________________。
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因和离子方程式是_____。
。
(4)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),则所消耗的硝酸的物质的量是________,
下图中的实验装置可用于制取乙炔。请填空:
(1)图中,A管的作用是。
制取乙炔的化学方程式是。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是,乙炔发生了反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是,乙炔发生了反应。
(4)为了安全,点燃乙炔前应,乙炔燃烧时的实验现象是。
写出下列反应的化学方程式,并指出反应类型:
(1)乙炔与足量的溴水完全反应
(2)丙烯与氯化氢在一定条件下反应生成2—氯丙烷
(3)用乙炔制取聚氯乙烯