“温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有 (填字母)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) △Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) △H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是 。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。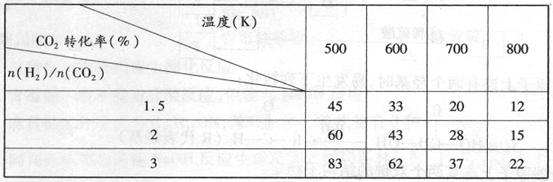
根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率 (填“增大”“减小”或“不变”)。
②该反应的正反应为 (填“吸”或“放”)热反应。
氨在国防、工农业等领域发挥着重要作用。
(1)工业以甲烷为原料生产氨气的过程如下:
①过程Ⅰ中,有关化学反应的能量变化如下图所示
反应①为反应(填“吸热”或“放热”),CH4 (g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是。
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为: ,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是。(选填字母)。
,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是。(选填字母)。
a.高温、高压 b.高温、低压
c.低温、低压 d.低温、高压
③下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是。
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)= 0.1mol,
n(H2)= 0.3mol。下列图象能正确表示该过程中相关量的变化的是。(选填字母)。
(2)直接供氨式固体氧化物燃料电池能量转化率达85%,其结构示意图如图所示:
①负极的电极反应式是______。
②用该电池电解300ml的饱和食盐水。一段时间后,溶液pH=13(忽略溶液体积的变化),则消耗NH3溶液的体积是_____L。(标准状况)
侯氏制碱法制取纯碱的生产流程如图所示:
某小组同学在实验室模拟该流程制纯碱,设计如下:
可供选择的试剂有:6 mol·L-1盐酸、6 mol·L-1硫酸、浓氨水、生石灰、石灰石、氯化铵、蒸馏水和冰。(夹持仪器略)
请回答:
(1)A装置中所装试剂是和,B装置的作用是。
(2)用相关化学用语说明D装置制取气体的原理。
(3)检验D装置中产生的气体的方法。
(4)根据下表中四种物质的溶解度,回答:
①侯氏制碱是在30 0C左右进行生产的,那么沉淀池中在30 0C时析出的物质X是,分离方法。C装置中反应的化学方程式是。
②依据上表和工业流程图,为了从C装置中分离后的溶液中得到更多的副产品NH4Cl,可采取的措施是。
a.加NH3和NaCl b.通入CO2c.降低温度
(5)C装置中产品X经煅烧得到纯碱,其中常含有少量的NaCl,为测定其纯度,某实验小组设计的以下方案正确的是。
①取纯碱样品a g于试管中,溶解后,加入过量盐酸,用碱石灰吸收产生的气体,碱石灰增重b g。
②取纯碱样品a g于试管中,溶解后,先加入过量硝酸酸化,再滴加过量的AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g。
③取纯碱样品a g于试管中,溶解后,滴加过量的CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g。
研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
(2)SO2可用足量的NaOH溶液吸收,该反应的离子方程式为______;若继续通入SO2,当n (SO2): n(NaOH)=1:1时所得溶液呈酸性,下列关系正确的是_____ (填字母编号)。
a. c(Na+)> c(HSO3-)> c(SO32-)
b. c(Na+)+ c(H+)= c(SO32-)+ c(HSO3-)+ c(OH-)
c. c(Na+)= c(SO32-)+ c(HSO3-)
SO2也可用O2氧化生成SO3
已知:①NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
SO3(g)+NO(g) ΔH =" -41.8" kJ/mol ;
②2NO(g)+O2(g)  2NO2(g)ΔH =" -113.0" kJ/mol ;
2NO2(g)ΔH =" -113.0" kJ/mol ;
则反应2SO2(g)+O2(g)  2SO3(g)ΔH=______ kJ/mol。
2SO3(g)ΔH=______ kJ/mol。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
①该反应ΔH______0(填“>”或“<”)。
②若容器容积不变,下列措施可提高CO转化率的是_____。
a.升高温度 b.将CH3OH(g)从体系中分离
c.充入氦气,使体系总压强增大 d.再充入一定量的 CO气体
H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第________周期第________族;C的基态原子核外有_________对成对电子;Cl原子的价电子表示式________.
(2)用“>”、“=”、“<”填空
| 稳定性 |
得电子能力 |
离子半径 |
电负性 |
| CH4____NH3 |
1H_____2H |
Na+_____Al3+ |
C____Al |
(3)用电子式表示NaCl的形成过程:__________________________________________.
(4)已知在常温常压下:
| 化学键 |
H—H |
H—Cl |
Cl—Cl |
| 键能kJ/mol |
a |
b |
c |
写出H2与Cl2反应的热化学方程式:_________________________________________.
[化学一选修3:物质结构与性质](15分)A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为;D和E的电负性大小关系为(用元素符号表示)。
(2)化合物E2D分子的空间构型为,中心原子采用杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为,任意写出一种它的等电子体的化学式为。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于晶体,晶体内含有的作用力类型有。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为g/cm3。