已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.0kJ·mol-1
2SO3(g) ΔH=-196.0kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
2SO3(l) 2SO3(g) ΔH=" 20.0" kJ·mol-1
2SO3(g) ΔH=" 20.0" kJ·mol-1
则NO2与SO2反应生成SO3(l)和一种无色气体的热化学方程式 ;
若在一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
②该反应达平衡时,测得NO2的转化率为50%,则反应前后容器内压强比为 。
③恒压密闭容器中发生上述反应时,若加入Ar气,使得反应速率 (变大、变小或不变)。
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。则: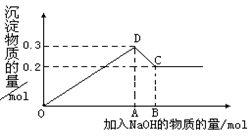
(1)写出代表各线段发生反应的离子方程式:
OD段. _______,
DC段 __________________________。
(2)原溶液中Mg2+.Al3+物质的量浓度之比为。
(3)图中C点表示当加入mol NaOH时,Al3+已经转化为 ,Mg2+已经转化为。
(4)图中线段OA∶AB=。
取标准状况下2.24L某气态烃A置于密闭容器中,再通入足量的O2,用电火花引燃,燃烧产物的定量测定实验数据如下(图中的箭 头表示气体的流向)。
头表示气体的流向)。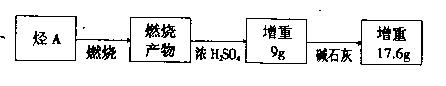
试通过计算回答:
(1)烃A的分子式为。
(2)写出烃A的所有同分异构体的结构简式:。
(3)某有机物B仅含碳、氢、氧三种元素,其相对分子质量大于100,小于10 6。已知A、B分子中所含的氢原子数相同,则B的分子式为。
6。已知A、B分子中所含的氢原子数相同,则B的分子式为。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2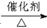 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。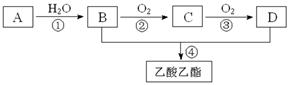
回答下列问题:
(1)A的结构式为。
(2)写出下列反应的反应类型:①,②,④。
(3)B、D分子中的官能团名称分别是、。
(4)除去乙酸乙酯中所混有少量的D杂质,所需试剂的名称是:。
(5)写出下列反应的化学方程式:(注明反应条件)
① ;
;
②;
④。
(6)若184gB和120gD反应能生成106gE,计算该反应的产率为。
(7)判定B能否直接被氧化为D,若能,指出所用的氧化剂是什么(若不能,此空不填);若不能请说明理由(若能,此空不填)。
A、B、C、D四种短周期元素,A、B同主族,C、D同周期。气体A2与气体C2按体积比2:1混和后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体。B的阳离子与C的阴离子的核外电子排布相同。D能形成自然界硬度最大的单质。请根据上述所提供的信息回答下列问题。
(1)写出A、B、C三种元素的名称:A;B ;C;D在周期表中的位置是。
(2)写出化合物B2C2的电子式。
(3)写出B2C2和A2C反应的离子方程式:。
(4)用电子式表示A2C形成的过程:。
(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
(2)乙烷中含有乙烯除杂试剂为;
反应的化学方程式为。
(3)在10L密闭容器中充入2molA和1molB,发生的化学反应:3A(g)+B(g)  C(g)
C(g)
+2D(g),2min后反应达到平衡,在相同温度下,测得平衡时容器内气体的压强是反应前的5/6,试填写下列空白:
①用气体B表示的2min内的平均反应速率为。
②平衡时,A的浓度为mol/L。
(4)我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。电池负极反应为,
正极反应。