(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)溴在周期表中位于第 _周期第 _族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 _。
(3)步骤④利用了SO2的还原性,反应的离子方程式为 _。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因 _。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 _。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是 _。
红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
根据上图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式:
;
(2)PCl5分解生成PCl3和Cl2的热化学方程:
;温度T1时,在密闭容器中加入0.8mol PCl5 ,反应达到平衡时还剩余0.6mol PCl5 ,其分解率α1等于
(3)P和Cl2分两步反应生成1mol PCl5的△H3=;
P和Cl 2一步反应生成1mol PCl5的△H4△H3(填“大于”,“小于”或“等于”) 。
2一步反应生成1mol PCl5的△H4△H3(填“大于”,“小于”或“等于”) 。
实验题:(本题共9分)某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下滴定操作:
| A.在250 mL的容量瓶中配制250 mL烧碱溶液; | B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂; | C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解; | D.将物质的量浓度为cmol/L的标准盐酸溶液装入酸式滴定管。调整液面记下开始读数为V1 mL;E.在锥形瓶下垫一张白纸,滴定最后一滴至红色刚好消失 为止,半分钟后不恢复红色,记下读数V2 mL。 为止,半分钟后不恢复红色,记下读数V2 mL。 |
就此实验完成下列填空:
(1)正确操作步骤的顺序是:(用编号字母填写)。
( 2)观察滴定管里液面的高度时应注意:。
2)观察滴定管里液面的高度时应注意:。
(3)E步骤的操作中在锥形瓶下垫一张白纸的作用是。
(4)D步骤的操作中液面应调节到,尖嘴部分应。
(5)某学生实验时把锥形瓶用烧碱样品洗涤,使测定的浓度偏高还是偏低?
(6)该烧碱样品纯度的计算式为:
中学化学中几种常见物质的转化关系如下: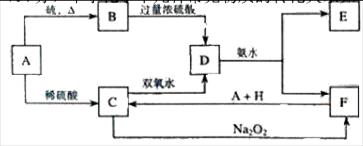
将 D滴入氢氧化钠溶液中可得到F的红褐色沉淀。请回答下列问题:
(1)A、B、C、D、 E、F、H的化学式:AB __
E、F、H的化学式:AB __ _________、D ___________、E。
_________、D ___________、E。
(2)写出 C的酸性溶液与双氧水反应的离子方程:________________________。
(3)写出鉴定E中阳离子的离子方程式:。
请在横线部分写出正确的化学方程式或离子方程式(每题2分,共12分)
(1)镁在二氧化碳中燃烧。
(2)铝与碱溶液反应的离子方程式。
(3)实验室制氢氧化铝的离子方程式。
(4)铝与四氧化三铁高温反应。
(5)氢氧化亚铁在空气中变质。
(6)少量铁在氯气中燃烧 。
。
(本题共 7分)把金属铁加入含FeCl3、FeCl2、CuCl2的混合液中充分反应后,
(1)铁全部溶解,且没有固体,则滤液中肯定有的阳离子,可能有的阳离子 (2)过滤,滤出不溶物有铜,则滤液中肯定有的阳离子,肯定不存在的阳离子,可能有的阳离子
(2)过滤,滤出不溶物有铜,则滤液中肯定有的阳离子,肯定不存在的阳离子,可能有的阳离子
(3)过滤,滤出不溶物有铁,则滤液中肯定有的阳离子,肯定不存在的阳离子。