如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。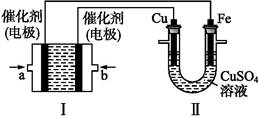
(1)a处应通入 (填“CH4”或“O2”),b处电极上发生的电极反应式是 ;
(2)电镀结束后,装置Ⅰ中溶液的pH (填“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度 ;
(3)电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有 (忽略水解);
(4)在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
已知A、B,C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下图进行反应。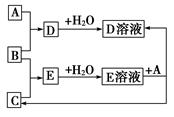
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的________,理由是________。
(3)如果E溶液是一种强酸,则E的化学式为________。
无机化合物可根据其组成和性质进行分类:
(1)下图所示的物质分类方法名称是________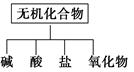
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
HCl②____ |
③___④Ba(OH)2 |
⑤Na2CO3⑥____ |
⑦CO2⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式_____________________________
(4)呼吸面具中用⑧作为O2来源的反应原理为:___________________________
(5)实验室制备⑦常用________和________反应,检验该气体的方法是____________
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2。按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①________________________________。
②________________________________。
(2)从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式__________________________________________________
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系:___________________________。
(4)生活中的食醋和淀粉溶液分别属于分散系中的________和________,用________可以鉴别(填化学专用名词)。
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: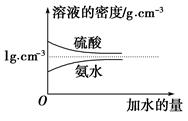
| 溶质的物质的量浓度/mol·L-1 |
溶液的密度/g·cm-3 |
|
| 硫酸 |
c1 |
ρ1 |
| 氨水 |
c2 |
ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与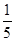 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________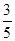 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶某品牌“84消毒液”,
并查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25% NaClO、1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L-1。
(2)该同学取100 mL该品牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)≈________mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)该同学参阅该品牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液。下列说法正确的是________。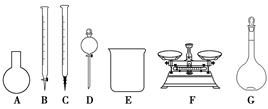
| A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量的NaClO固体质量为143 g |