人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。
总反应式为:N2+3H2 2NH3
2NH3
则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;
向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3相应的反应方程式为:2N2(g)+6 H2O (g)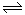 4NH3(g)+3O2(g)△H=Q ①
4NH3(g)+3O2(g)△H=Q ①
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3), 分别加 入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数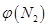 与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。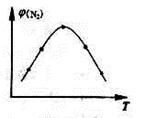
(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(填字母代号),图中△H绝对值为1530kJ·mol-1。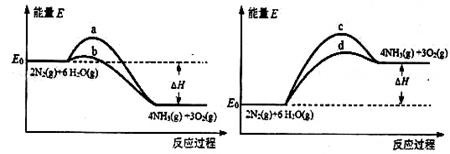
III.目前工业合成氨的原理是: N2(g)+3H2(g)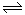 2NH3(g)△H=-93.0kJ/mol ②
2NH3(g)△H=-93.0kJ/mol ②
回答下列问题:
(1)结合II中的数据,则2H2(g)+ O2(g)="2" H2O (g)的△H=___________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率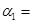 ______________。
______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率
为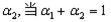 时,则起始时NH3的物质的量
时,则起始时NH3的物质的量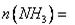 _________mol。
_________mol。
苹果酸广泛存在于苹果等水果的果肉中,是一种常用的食品添加剂。经测定,苹果酸的相对分子质量为134,所含各元素的质量分数为:
 ,其中存在5种不同化学环境的H原子。1mol苹果酸能与2molNaHCO3完全反应、能与足量的Na反应生成1.5molH2的。用乙烯为原料人工合成苹果酸的线路如下:
,其中存在5种不同化学环境的H原子。1mol苹果酸能与2molNaHCO3完全反应、能与足量的Na反应生成1.5molH2的。用乙烯为原料人工合成苹果酸的线路如下:
已知:
请回答下列问题:
(1)苹果酸的分子式为_______ 。A物质的名称为_______。
(2)F中含有的官能团名称是_______ 。G+B→H的反应类型是_______。
(3)在合成线路中,C→D这一步骤反应的目的是_____。
(4)D→E反应的化学方程式为_________.
(5)苹果酸和NaHCO3完全反应的化学方程式为________。
(6)与苹果酸含有相同种类和数县的官能团的同分异构体的结构简式为_______。
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:
①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:  。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时
 ]。
]。
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为一常见金属,酸G是重要的化工产品和化工原料;固体H能够溶解在A溶液和酸G中,且H为良好的耐火材料(图中部分产物没有列出)。
(1)固体甲与液体M反应的方程式为______。A溶液与固体H反应的离子方程式为______。
(2)固体乙的化学式为_______。液体M的电子式为_______。
(3)反应①~⑦中属于氧化还原反应的为_______(填写反应序号)。
(4)若I与C的稀溶液不反应,只能与G的浓溶液在加热条件下反应,则反应⑦的化学方程式为_______。
(5)若由黄铁矿(FeS2)与气体B反应来生产气体E,且每生成1 mol E放出426.5 kJ的热量,该反应的热化学方程式为_______ 。
以烯烃为原料,合成某些高聚物的路线如下:
已知: (或写成
(或写成 )
)
(1)CH3CH=CHCH3的名称是_______________。
(2)X中含有的官能团是___________________。
(3)A→B的化学方程式是__________________。
(4)D→E的反应类型是_______________。
(5)甲为烃,F能与NaHCO3反应产生CO2。
①下列有关说法正确的是_______________。
| A.有机物Z能发生银镜反应 | B.有机物Y与HOCH2CH2OH互为同系物 |
| C.有机物Y的沸点比B低 | D.有机物F能与己二胺缩聚成聚合物 |
②Y的同分异构体有多种,写出分子结构中含有酯基的所有同分异构体的结构简式____________。
③Z→W的化学方程式是__________________。
(6)高聚物H的结构简式是_________________。