〔︱〕(3分)物质的加热是中学化学实验的重要基本操作。常用加热方式有3类:①直接在酒精灯上加热;②通过石棉网用酒精灯加热;③通过水浴加热。以下10个中学化学实验中有的要加热,有的不要加热:
A 用双氧水和二氧化锰制取氧气 B 食盐溶液蒸发制取氯化钠晶体
C 氯化铵与碱石灰反应制取氨气 D 浓硝酸和铜反应制取二氧化氮气体
E.乙醇和浓硫酸制取乙烯 F.石油的分馏
G.苯与溴在铁催化下制取溴苯 H.乙醛溶液与银氨溶液发生银镜反应
I.乙酸乙酯在酸性条件下发生水解 J.葡萄糖与新制的氢氧化铜悬浊液反应
其中:(1)可用酒精灯直接加热的有 。
(2)用酒精灯通过石棉网加热的有 。
(3)通常用水浴加热的有 。
〔‖〕现有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞
⑤Ba2SO4固体 ⑥纯蔗糖(C12H22O11) ⑦酒精(C2 H5OH) ⑧熔化的KNO3,
请回答下列问题(用序号):
(1)以上物质中能导电的是___________。
(2)以上物质中属于非电解质的是________。
(3)以上物质中属于电解质的是__________。
(4)以上物质中溶于水后形成的水溶液能导电的是__________。
某废液中含有大量的K+ 、Cl- 、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图: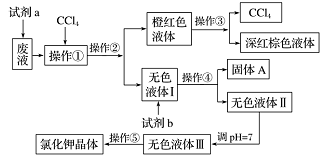
可供试剂 a、试剂 b(试剂 b代表一组试剂)选择的试剂:饱和 Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O溶液(H+)、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)操作⑤中用到的瓷质仪器名称是_____。
(2)操作①②③④⑤的名称是_____(填字母)。
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
(3)试剂a应该选用__________,反应的离子方程式为_______________。
(4)除去无色液体Ⅰ中的Ca 2+、Mg2+、SO42-,选出试剂b所代表的试剂,按滴加顺序依次是_____(填化学式)。
(5)调节pH的作用是__________,涉及的化学方程式有_______________、_______________。
本题有两部分
I:软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.4g纯净MnO2最多能氧化____________L(标准状况)SO2。
(2)上述反应制得的溶液,调节pH值到5~7的范围,以除去Fe3+、 Al3+(使其浓度小于l×10-6mol·L-1),然后从得到的MnSO4和 MgSO4混合溶液中结晶MnSO4·H2O晶体,下图可以看出,需控制结晶温度在_______以上。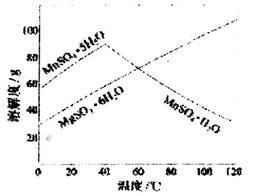
II:以磷石膏(主要成分CaSO4,杂质SiO2、A12O3等)为原料可制备轻质CaCO3。
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见下图。清液pH>11时CaSO4转化的离子方程式_______________________
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为SO42-和_______(填化学式);检验洗涤是否完全的方法是____________。
(3)磷石膏若用氢氧化钠溶液溶解,发生反应的有关离子方程式为:
_________________________________ 、____________________________________
单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物.Y为氢化物,分子结构与甲烷相似,回答下列问题;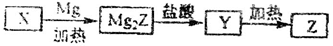
(1)能与X发生化学反应的酸是_______(写名称);由X制备Mg2Z的化学方程式为___ __。
(2)由Mg2Z生成Y的化学反应方程式为___________________,Y分子的电子式为________________
(3)Z、X中化学键的类型都是_________________。
根据要求回答下列有关元素化合物的有关问题
I:我国空气质量预报的内容主要包括三个方面:二氧化硫、氮氧化物、悬浮颗粒物等三种大气污染物的浓度。
(1)与氮氧化物有关的全球或区域性大气环境问题有_______(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾d.白色污染
悬浮颗粒物可用高压电除尘是利用了_______现象
(2)为了降低汽车尾气对大气的污染,目前最有效的方法是给汽车安装尾气净化装置。它能将一氧化碳和NO在催化剂作用下发生反应转化为无害气体,其反应的化学方程式为_________ ___________.
(3)写出实验室中由固体物质制取氨气的化学方程式______________________________;
已知AgNO3光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为___________。
II:铁在自然界存在广泛,在工业、农业和国防科技中有重要应用。
(1)用铁矿石(赤铁矿)冶炼生铁的原料中除铁矿石和焦炭外还有石灰石,写出石灰石除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为______________________________;高炉排出气体的主要成分有N2、CO2和________________(填化学式)。
(2)铁矿石中常含有硫,使高炉气中混有SO2污染空气。工业脱SO2的方法可以用______。(填字母序号)
a.氨水 b.浓硫酸 e.氢氧化钠溶液 d.稀硝酸
(3)配制的FeCl2溶液中会含有少量FeCl3,检验FeCl3常用的试剂是_________(填试剂的名称)。欲除去其中的FeCl3,应在该FeCl2溶液加入______________。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 (用必要的文字和离子方程式说明)。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl—)=5.3×10-2mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  ClO3-+
ClO3-+  Fe2++
Fe2++  =
=  Cl-+
Cl-+  Fe3++
Fe3++  .
.