丁达尔效应是区分胶体与溶液的一种最常用的方法。
(1)如图所示是在实验室中进行氢氧化铁胶体丁达尔效应实验的示意图,该图中有一处明显的错误是
(试从分散系的分类进行讨论说明)。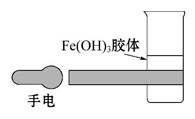
(2)欲在树林中观察到丁达尔效应,你认为一天中最有可能观察到该现象的时间是 ,理由是
。
(3)去树林观察丁达尔效应有诸多不便,聪明的你能想出许多在家里观察丁达尔效应的方法,其中最简单、最环保的方法是
。
(4)有下列词语:
| A.渗析、 | B.聚沉、 | C.电泳、 | D.丁达尔效应,选出适当的词语将其序号填入下列空白处。 |
①在肥皂水中透过强光,可看到光带,这种现象称为 。
②在Fe(OH)3胶体中加入(NH4)2SO4产生红褐色沉淀,这种现象叫做 。
③用半透膜把制取Fe(OH)3胶体中生成的氯化钠分离出的方法叫做 。
④在水泥和冶金工厂常用高压电对气溶胶作用,除去大量烟尘,以减小对空气的污染。这种做法应用的主要原理是 。
25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① _________________________;
② _________________________;
③ _________________________。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
(1)浓度均为0.01 mol·L-1的8种溶液:①HNO3 ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤NaOH
⑥CH3COONa ⑦KCl ⑧NH4Cl,这些溶液pH由小到大的顺序是(填写编号) 。
(2)pH=2的某酸HnA(An+为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8。
①反应生成的正盐的化学式为 。
②该盐中 离子一定能水解,其第一步水解的离子方程式为 。
(1)把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条,观察到有气泡产生,点燃有爆鸣声,此气体是 ,产生该气体的原因是 (用离子方程式表示),微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 ,产生该气体的原因是 ,总的离子反应方程式为 。
(2)NH4Cl溶于重水后,产生的一水合氨和水合氢离子均正确的是( )
| A.NH2D·H2O和D3O+ | B.NH3·D2O和HD2O+ |
| C.NH3·HDO和D3O+ | D.NH2D·HDO和H2DO+ |
测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式 。
(2)判断滴定终点的方法是 。
(3)计算:血液中含钙离子的浓度为 g·mL-1。
某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是 。