某银白色金属固体A:①放在空气中氧化成白色固体B;②将A点燃火焰呈黄色,生成浅黄色固体C;③A、B、C均可跟无色液体D反应,生成碱性物质E,其中A跟D反应时还可生成可燃性气体F,C跟D反应时则生成另一种气体G;④F和G混合遇火可剧烈反应而发生爆炸,并生成D。
据此推断:
(1)C为 ,D为 ,F为 。
(2)写出下列反应的化学方程式:
①A→B: ;
②C→E: 。
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:
①开始时导电率为0说明:。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):ab;c(CH3COO-):ab;完全中和时消耗NaOH的物质的量:ab;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为mol/L;计算b点时醋酸的电离平衡常数,写出计算过程。
(2)已知:H+(aq) + OH-(aq) = H2O(l)△H1="-57.3" kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq)△H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq)△H2="+1.3" kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式:。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式;并列出其中的离子浓度大小顺序(由大到小)。
已知苯甲醛与乙酸酐[(CH3CO)2O]在一定条件下可以通过Perkin反应生成肉桂酸,方程式(已配平)如下:
苯甲醛肉桂酸
(1)1mol苯甲醛与足量银氨溶液在水浴条件下反应最多能生成mol银单质;写出肉桂酸完全加氢后产物的分子式。
(2)上述反应中的产物M能与碳酸氢钠反应并放出气体,则M的结构简式是。
(3)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,其反应方程式为
(不要求标出反应条件),该反应类型属于。
已知:在药物、香料合成中常利用醛和醇反应生成缩醛来保护醛基,此类反应在酸催化下进行。例如:
(4)已知具有五元环和六元环结构的缩醛比较稳定。写出用乙二醇(HOCH2CH2OH)保护苯甲醛中醛基生成的缩醛B(分子式:C9H10O2)的结构简式。
(5)缩醛B(分子式:C9H10O2)符合以下条件的同分异构体有两种,写出它们的结构简式。
①苯环上只有一个取代基;②能发生水解反应和银镜反应。
Suzuki偶联反应在有机合成上有广泛应用,该方法可以应用于合成昆虫信息素。其反应①如下(Ph-代表苯基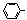 ):
):
反应①: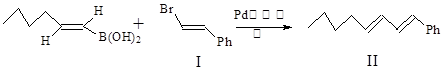
化合物I可以由以下途径合成:
(1)化合物I的分子式为,1mol化合物III完全燃烧消耗氧气mol。
(2)化合物IV的结构简式为,化合物V转化为化合物VI的反应类型为。
(3)写出化合物VI在足量的NaOH溶液中共热反应的方程式。
(4)已知化合物Ⅶ是化合物V的同分异构体,化合物Ⅶ的核磁共振氢谱中有 4种峰,峰面积之比为3:2:2:1,且1mol Ⅶ与足量银氨溶液反应生成4mol Ag单质,写出化合物Ⅶ的结构简式。
(5)化合物(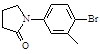 )与化合物(
)与化合物(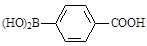 )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式。
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式。
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| Fe3+ |
Cu2+ |
Cr3+ |
|
| 开始沉淀pH |
2.1 |
4.7 |
4.3 |
| 完全沉淀pH |
3.2 |
6.7 |
a |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到;②将浊液加热到80℃,。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是。
(4)当离子浓度≤1×10—5 mol•L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持C(OH—)≥。已知:Ksp[Cr(OH)3]=6.3×10-31, )
)
甲醇是一种用途广泛的化工原料。
(1)工业上常用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol
②CO2(g)+ 3H2(g)  CH3OH(g) + H2O(l)ΔH2
CH3OH(g) + H2O(l)ΔH2
已知:CO(g)+ H2O (g) = CO2 (g) + H2 (g)ΔH3=-41.1 KJ/mol③
H2O (l) =H2O (g)ΔH4=+44.0KJ/mol④
则ΔH2=
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如下表所示:(前6min没有改变条件)
| 2min |
4min |
6min |
8min |
… |
|
| CO |
0.07 |
0.06 |
0.06 |
0.05 |
… |
| H2 |
x |
0.12 |
0.12 |
0.2 |
… |
| CH3OH |
0.03 |
0.04 |
0.04 |
0.05 |
… |
①x=。
②250℃时该反应的平衡常数K值为:(不必化简)。
③若6min~8min只改变了某一条件,所改变的条件是。
④第8min时,该反应是不是达到平衡状态。(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ.。
(3)电解甲醇水溶液制氢的优点是需要的电压低,而且制得的氢气比电解相同物质的量的水多。写出电解甲醇水溶液的反应式为:阳极:。