“钾泻盐”的化学式为MgSO4·KCl·xH2O,是一种制取钾肥的重要原料,它溶于水得到KCl与MgSO4的混合溶液。某化学活动小组设计了如下实验方案: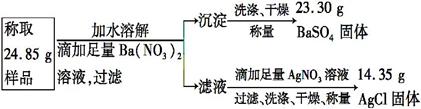
以下说法不正确的是 ( )
| A.该方案能够计算出“钾泻盐”中KCl的质量分数 |
| B.足量Ba(NO3)2溶液是为了与MgSO4充分反应 |
| C.“钾泻盐”化学式中x=2 |
| D.上述实验数据的测定利用学校实验室里的托盘天平即可完成 |
下列化合物中,不能由单质直接化合而得到的是
| A.Fe3O4 | B.Na2O2 | C.Al2O3 | D.NaAlO2 |
下列有关钠的叙述正确的是
①钠在空气中燃烧生成氧化钠②金属钠可以保存在煤油中③钠与硫酸铜溶液反应,可以置换出铜④金属钠有强还原性⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价
| A.①②④ | B.②③⑤ | C.①④⑤ | D.②④⑤ |
用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu =2Fe2++ Cu2+。下列有关说法错误的是
| A.Cu是还原剂,被腐蚀 | B.Fe3+是氧化剂 |
| C.该反应是置换反应 | D.该反应属于离子反应 |
下列离子方程式中正确的是
| A.澄清石灰水与稀盐酸反应 Ca(OH)2 + 2H+==Ca2+ + 2H2O |
| B.氢氧化钡与硫酸反应 OH- + H+==H2O |
| C.铜片插入硝酸银溶液中 Cu + Ag+ = Cu2+ + Ag |
| D.氯化镁溶液与氢氧化钠溶液反应 Mg2+ + 2OH-=Mg(OH)2↓ |
下列各组中的离子,能在溶液中大量共存的有
| A.Na+、H+、CO32-、Cl- | B.Na+、Ba2+、Cl-、SO42- |
| C.K+、 H+、SO42-、OH- | D.Ag+、Al3+、NO3-、H+ |