某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的一种或几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题:
(1)溶液中一定含有的溶质是 ,一定不含有的溶质是 (填化学式)。
(2)溶液中可能含有的溶质是 (填名称),判断该物质是否存在的实验方法是 ,现象是 。
(3)分别写出AB段、BC段发生反应的离子方程式:
①AB段为 ;
②BC段为 。
【化学—选修有机化学】
根据下列有机化合物,回答问题。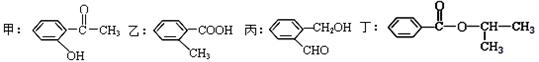
(1)上述互为同分异构体的化合物为;
(2)写出丙中官能团的名称;
(3)丁在一定条件下,可以发生水解反应,生成X、Y两种物质(相对分子质量:X<Y)。由X经下列反应可制得N、F两种高分子化合物,它们都是常用的塑料。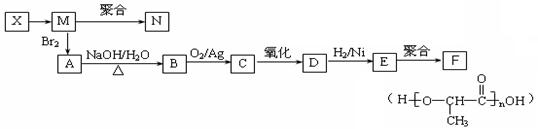
①X转化为M的反应类型是。
②写出B转化为C的化学方程式;
③C与新制氢氧化铜反应的化学方程式为:。
④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为。
⑤写出3种含有一个羟基、一个酯基的E的同分异构体的结构简式:
、、
(15分)图1是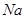 、
、 、
、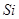 、
、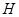 、
、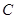 、
、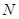 等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是
等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含个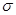 键,个
键,个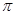 键。
键。
(3)a与b的元素形成的10个电子中性分子X的空间构型为;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成d元素的离子化学式为,其中X与d 高价离子之间以键相结合。
(4)图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:。
(5)图中C单质的晶体堆积方式类型是,这种堆积方式晶胞中原子的配位数为。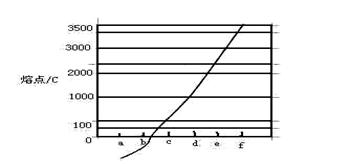
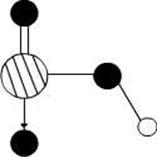
图1图2
【化学一选修2化学与技术】
已知:①工业上用硫酸与锂辉矿(LiA1Si2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用β锂辉矿与硫酸等物质制备金属锂的工业流程如下: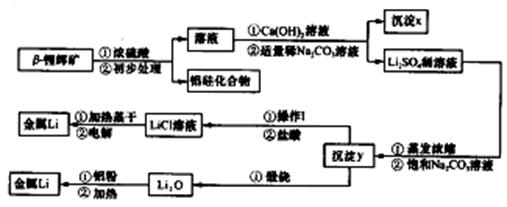
请回答:(1)沉淀y的主要成分的化学式是。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其浓度不同的原因是。
(3)操作I涉及的实验方法是。
(4)写出用铝粉还原法制取金属锂的化学方程式。
(5)LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是。
(6)目前电池通常使用金属锂的优点是。
I、(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA + HB- (少量)=A_ + H2B ,②H2B(少量) + C- = HB_ + HC ,③HA(少量) + C- =A_ + HC 。则三种酸对应的电离平衡常数分别为(请填空)
| HA |
H2B |
HC |
||
| Ka |
Ka1 |
Ka2 |
Ka3 |
Ka4 |
| 数值 |
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小是:_______
A c(H+) B c(H+)/c(CH3COOH) C c(H+)·c(OH-)
Dc(OH-)/(H+)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数_____(填大于、等于或小于)醋酸平衡常数;理由是___________________________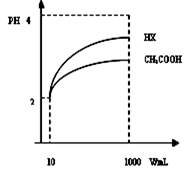
II、工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。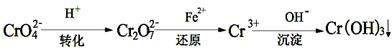
(1)转化过程中存在平衡2CrO42- + 2H+ Cr2O72- + H2O能说明反应到达平衡状态的是
Cr2O72- + H2O能说明反应到达平衡状态的是
A.CrO42-和Cr2O72-的浓度相同 B.2ν(Cr2O72-)=ν(CrO42-)
C.溶液的pH值保持不变 D.溶液颜色保持不变
(2)若1L转化后所得溶液中含铬元素质量为28.6g,CrO42-有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。①转化后所得溶液中c(Cr2O72-)=
②已知:常温下该反应的平衡常数K=1014,上述转化后所得溶液的pH为
(3)还原过程中的离子反应方程式
(4)若常温下Ksp(Cr(OH)3)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol ,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
二、下表为B与F实验的部分内容
①在含B的溶液中加入稀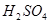 ,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 ,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀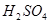 反应的离子方程式
反应的离子方程式
写出②中反应的化学方程式
(3)现由6种粒子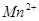 、
、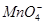 、
、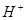 、
、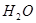 、
、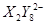 (C中含有的阴离子),
(C中含有的阴离子),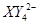 完成一个离子方程式,已知
完成一个离子方程式,已知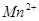 为还原剂,得到1mol
为还原剂,得到1mol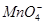 需氧化剂的物质的量为mol
需氧化剂的物质的量为mol
(4)化合物D和E相互转化D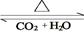 E,若有D和E ·
E,若有D和E ·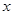 H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E ·
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E ·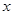
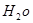 的化学式为
的化学式为