(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
科学家把药物连接在高分子载体上,要制成缓释长效药剂,阿司匹林是常用解热镇痛药物,其结构简式如A;把它连接在某化合物上,形成缓释长效阿司匹林,其结构简式如B。 
(1)缓释长效阿司匹林中含酯基的数目是__________。
(2)阿司匹林连接在高分子载体上的有机反应类型是__________。
(3)此高分子载体的结构简式是____________________。
(4)服药后,在人体内发生反应,释放出阿司匹林的化学方程式为_____________________。
抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。
(1)抗酸药物具有抗酸作用的原因是______________________________________________。
(2)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
①写出该抗酸药发挥功效时的离子方程式:______________________________、______________________________。
②淀粉在抗酸药中作填充剂、黏合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写结构简式)______________________________。
我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO 3 ),据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一__________。
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患___________。
A.甲状腺亢进 B.贫血症 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾淀粉溶液,检查食盐中是否含碘酸钾。反应的化学方程式为
5KI+KIO 3 +6HCl="===6KCl+3I" 2 +3H 2 O。
此反应的氧化剂是__________(填化学式),可观察到的现象是__________。
下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品名 |
××× |
| 配料 |
鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、碳酸氢钠、柠檬酸、柠檬汁、食盐、甜蜜素、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 保质期 |
240天 |
| 生产日期 |
标于包装袋封口上 |
(1)富含蛋白质的是__________;
(2)富含糖类的是__________;
(3)富含油脂的是__________;
(4)富含维生素的是__________;
(5)属于着色剂的有__________;
(6)属于调味剂的有__________;
(7)属于防腐剂的有__________;
(8)属于疏松剂的有__________。
大麻酚及它的衍生物都属麻醉药品,并且毒性较强。吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中。吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高。大麻酚分子结构为
回答下列问题: 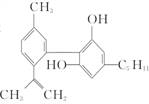
(1)大麻酚的分子式为__________。
(2)写出大麻酚燃烧的化学方程式:______________________________________________。
(3)大麻酚属酚类化合物,写出大麻酚与NaOH及足量溴水的反应产物__________。