硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。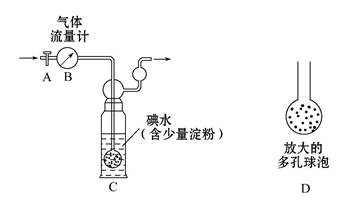
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是
。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种: 。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”“偏低”或“无影响”)。
乙方案:实验步骤如以下流程图所示: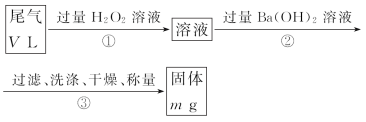
(4)写出步骤②中反应的化学方程式 。
(5)步骤③中洗涤沉淀的方法是 。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为 (用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与乙方案相同。
(7)你认为丙方案是否合理,说明理由:
。
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1) 写出C的化学式,H的化学式。
(2) B与氢氧化钠溶液反应的化学方程式为: 。
(3) G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为,当生成2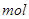 二氧化氯时,转移电子
二氧化氯时,转移电子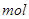 。
。
(4) 溶液F在空气中长期放置生成H的化学反应方程式为:
。
催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: 
(1)定性分析:如图甲可通过观察,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论________(填“合理”或“不合理”),理由是____________________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。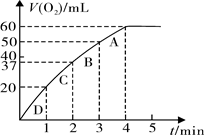
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如右图所示。
①实验时放出气体的总体积是mL。
②放出1/3气体所需时间为 min。
③计算H2O2的初始物质的量浓度_____________。 (请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑤解释④反应速率变化的原因 ___ _____。
某化学反应 3 A  2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验 1 ,反应在10 min ~20 min 内平均速率为_______ mol /(L·min)
(2)在实验 2 ,A 的初始浓度 C2 _______ mol / L ,反应经 20 min 就达到平衡,可推测实验 2 中还隐含的条件是____________________________
(3)比较实验3和实验 1,可推测正反应是______反应(填吸热或放热)。理由是____
某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。回答下列问题: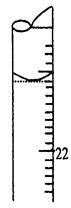
(1)正确的操作顺序是:B、、F(填序号);
(2)上述B步骤操作的目的是;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响
是(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为mL。
(6)根据读数计算出该待测液的浓度为。
苯和溴的取代反应的实验装置如图所示,其中A为带支管口的试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。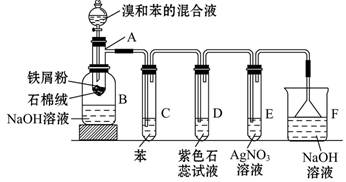
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):_______________________。
(2)试管C中苯的作用是__________。反应开始后,观察D和E两试管,看到的现象为________。
(3)反应2~3 min后,在B中可观察到的现象是_________。利用这种方法得到的粗溴苯中还含有的杂质主要是,需进一步提纯,下列操作中必须的是(填正确答案前的字母)
| A.蒸馏 | B.重结晶 | C.过滤 | D.萃取 |
(4)该实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是_____________。