二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象。为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:
①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过 注入稀硫酸、打开活塞,将产生的氢气导入到后续装置。
② 后关闭活塞,将装置D的导管插入烧杯中。
③通过装置B的 滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清。
④打开活塞,将产生的氢气导入后续装置一段时间。
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失。
⑥拆卸装置,清洗仪器,处理剩余药品。
请回答下列问题:
(1)实验步骤①和③的空白处使用的仪器分别为 、 ;
(2)装置C中苯的作用是 ;
(3)实验步骤②的操作为 ;
(4)实验步骤④的目的是 ;
(5)写出实验步骤⑤试管中发生反应的化学方程式
、 ;
(6)为了避免产生沉淀,你认为还应采取哪些措施,请举一例 。
实验室配制500 mL 0.1 mol/L Na2CO3溶液回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体(Na2CO3·10H2O)的质量为_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______ g (1 g 以下用游码)。
(3)配制Na2CO3溶液时需用的主要仪器有___________、药匙、__________、烧杯、__________、玻璃棒。
(4)若实验遇下列情况,溶液的浓度是偏高,偏低还是无影响?
A、容量瓶内壁附有水珠而未干燥处理______
B、忘记将洗涤液加入容量瓶_________
(5)若加水时不慎超过刻度线,如何处理?请你用简要的文字写出处理方法____
校学生用中和滴定法测定某NaOH溶液的物质的量浓度。
(1)盛装0.2000 mol/L盐酸标准液应该用式滴定管。
(2)当接近滴定终点时,很少量的碱或酸就会引起溶液的发生突变。
(3)有关数据记录如下:
| 实验序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.70 |
| 2 |
20.00 |
6.00 |
26.00 |
| 3 |
20.00 |
1.40 |
21.20 |
则NaOH溶液的物质的量浓度为______________mol/L。
(4)若只用蒸馏水冲洗锥形瓶,则测定结果_____________(填“无影响”、“偏高”或“偏低”)。
合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
〖实验方案一〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。实验中发生反应的化学方程式是
〖实验步骤〗
(1)称取5.4 g铝镁合金粉末样品,溶于VmL 2.0 mol/LNaOH溶液中,充分反应。则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
〖实验方案二〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
〖问题讨论〗
(3)同学们拟选用下列实验装置 完成实验:
完成实验:
①你认为最简易的装置其连接顺序是(填接口字母,可不填满):
A接( )( )接( )( )接( )
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
| A.待实验装置冷却后再读数 |
| B.上下移动量筒F,使其中液面与广口瓶中液面相平 |
| C.上下移动量筒G,使其中液面与广口瓶中液面相平 |
| D.视线与凹液面的最低点水平,读取量筒中水的体积 |
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:
。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:。
(3)本实验的关键在于关闭气体流量计的时机,请问应当在什么时候关闭活塞A:。
乙方案:实验步骤如以下流程图所示:
(4)写出步骤①中反应的化学方程式 。
。
(5)如何判断步骤②中沉淀是否完全的方法。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)
为(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案是否合理,说明理由:
。
下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
气体发生装置 |
| ① |
制备氧气 |
H2O2→O2 |
|
| ② |
制备氨气 |
NH4Cl→NH3 |
|
| ③ |
制备氯气 |
HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能 实现的是(填气体
实现的是(填气体
的化学式,下同);从反应原理看,明显不同于其他两种气体的是。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上
表中的空格中。
(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质: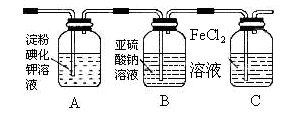
①通入氯气后,A中的现象是,整套实验装置存
在的明显缺陷是。
②C装置中发生反应的离子方程 式为:
式为:
 。
。
③请你帮该小组同 学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
(4)若用排空气法收集Cl2,在右边方框内画出气体收集装置图。