元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① |
|
|
||||||
| |
|
|
|
② |
③ |
④ |
|
|
| ⑤ |
|
⑥ |
⑦ |
|
|
|
|
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式_______。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答: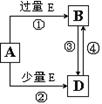
①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。
化合物G是合成抗癌药物美法伦的中间体,它的结构简式为: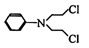
它可由中学常见的简单有机物为主要原料合成,其合成线路如下: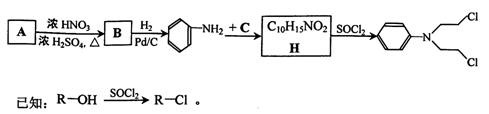
(1)D与A组成的元素相同,原子个数比也相同,按要求写出符合条件的D的结构简式:
①分子的空间构型为直线型的分子;
②分子中所有的碳原子均为sp3杂化的分子;
③NMR图谱中有5个峰,波峰面积之比为2:1:2:2:1的分子;
(2)B的一氯代物有三种同分异构体,B与足量氢气在一定条件下反应生成饱和有机物Y,则Y环上的一氯代物的同分异构体有种;
(3)已知氨气与醇在一定条件下能发生分子间的脱水反应。请写出氨气与物质C以物质的量之比为1:3反应生成的产物的结构简式,该有机物中含有的官能团的名称是,
(4)写出在加热且有浓硫酸存在条件下,H与乙二酸以物质的量比为1:1反应的化学方程式,
该反应的类型是。
(5)化合物H的一种同分异构体X,能与氯化铁溶液发生显色反应,且能与浓溴水反应,1 mol X最多消耗3 mol Br2,写出X的结构简式。(要求写出两种)
I.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为,该能层具有的原子轨道数为;
(2)液氨是富氢物质,是氢能的理想载体,利用 实现储氢和输氢。下列说法正确的是;
实现储氢和输氢。下列说法正确的是;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是;
II.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。
(1)设氯化钠晶体中Na+与跟它最近邻的Cl—之间的距离为r,则该Na+与跟它次近邻的C1—个数为,该Na+与跟它次近邻的Cl—之间的距离为;
(2)已知在氯化钠晶体中Na+的半径为以a pm,Cl—的半径为b pm,它们在晶
体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为;(用含a、b的式子袁示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为。
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备ClO2的流程如下: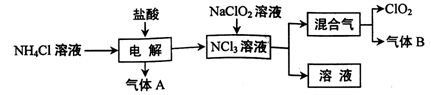
(1)ClO2中所有原子(填“是”或“不是”)都满足8电子结构。上图所示方法制得的混合气中杂质气体B能使石蕊试液显蓝色,除去该杂质气体可选用__;
A.饱和食盐水B.碱石灰C.浓硫酸D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离,还可能污染环境。写出该方法发生的化学方程式;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是
,此法相比欧洲方法的优点是
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为,此法提高了生产及储存、运输的安全性,原因是____。
能源是制约国家发展进程的因素之一。甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚。
(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜
[Cu(NH3)2Ac]溶液(Ac=CH3COO-)(来吸收合成气中的一氧化碳,其反虚原理为:
[Cu(NH3)2Ac](aq)+CO+NH3 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是;
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
反应b:CO(g)+2H2(g) CH3OH(g)△H<0
CH3OH(g)△H<0
①对于反应a,某温度下,将4.0 mol CO2(g)和12.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为;
②对于反应b,某温度下,将1.0mol CO(g)和2.0 mol H2(曲充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,温度和压强的关系判断正确的是;(填字母代号)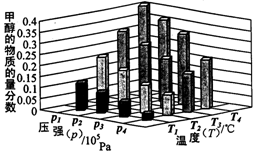
A.p3>p2,T3>T2
B.p2>p4,T4>T2
C.p1>p3,T1>T3
D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g) CH3OCH3(g)+H2O(g)△H<0
CH3OCH3(g)+H2O(g)△H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式;
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是(填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63 kJ,请写出表示二甲醚燃烧热的热化学方程式。
在元素周期表中,铝在硼的正下方,它们有很多相似的化学性质,可以形成许多组成和性质类似的化合物。单质硼可以通过硼镁矿Mg2B2O5·H2O来制取。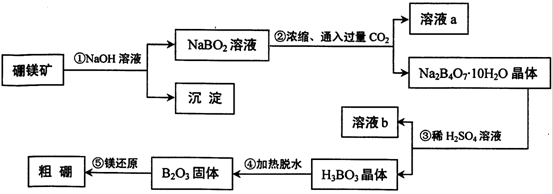
(1)写出步骤①的化学方程式,
(2)写出步骤②的离子方程式,
(3)写出表示溶液a物料守恒的关系;
(4)步骤③中加入稀H2SO4的作用是;
(5)将制得的粗硼在一定条件下反应全部生成BI3,BI3热分解可以得到纯净的单质硼。0.25 g粗硼制成的BI3分解得到的I2全部被收集后,用2.00 mol/L Na2S2O3溶液滴定,达到滴定终点时消耗27.00 mL Na2S2O3溶液。(已知:I2+2S2O32- 2I-+S4O62-)
2I-+S4O62-)
①滴定过程中所用的指示剂为,滴定终点的现象是;
②粗硼中硼的含量为____;
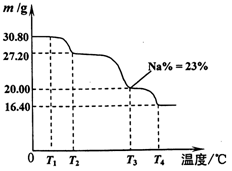
(6)利用硼砂晶体(Na2B4O7•10H2O)可制备过硼酸钠,它是一种优良的漂白剂,被广泛应用于洗衣粉、漂白粉、洗涤剂中。已知纯净的过硼酸钠晶体中各元素的物质的量之比为以n(Na):n(B):n(H):n(O)=1:1:n:7。取过硼酸钠晶体在70℃以上加热将逐步失去结晶水,测得固体质量随温度的变化如图所示,则乃时所得晶体的化学式为,请写出简要的解题过程。