苹果酸结构如下,常用做汽水、糖果的添加剂。
试写出苹果酸分别与下列物质反应的化学方程式:
(1)与Na 。
(2)与Na2CO3 _________________________________________________________。
(3)与CH3CH2OH按物质的量比1∶2反应(H2SO4,△)________________________。
某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g) C(g)+D(g) △H>0,当反应进行到10min末达到平衡,此时测得C的物质的量为1.2mol。回答下列问题:
C(g)+D(g) △H>0,当反应进行到10min末达到平衡,此时测得C的物质的量为1.2mol。回答下列问题:
(1)0~10min内A的平均反应速率为 。
(2)反应达平衡时B的转化率为 。
(3)在其他条件不变的情况下,将体积压缩到原来的1/2时,对反应产生的影响是 。
A.正反应速率增大,逆反应速率减小,平衡向正方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,各物质浓度不变
D.正、逆反应速率都增大,平衡不移动,各物质物质的量不变
(4)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 。
A.单位时间内消耗1molA,同时生成1molC
B.混合气体的密度不随时间而改变
C.混合气体的平均摩尔质量不随时间而改变
D.A和C在混合气体中的体积分数之比不随时间而改变
(5)若在其他条件不变的情况下,采取下列措施反应达平衡C的百分含量不变的是 。
A.通入He气B.使用催化剂
C.升高温度D.再充入2molA和3molB
(6)若保持原温度和容器容积不变再向其中充入2molA和1molB,平衡常数将 (填“增大” “减小”或“不变”),重新达到化学平衡状态时,此时平衡混合气体中C的体积分数为 。
常温时,将氨气溶于水形成一浓度为0.1mol/L,pH为10的氨水溶液100mL。
(1)该氨水溶液中含有的微粒有NH3·H2O、OH-、H2O和 。
(2)该氨水溶液中水电离出的c(OH-)为 。
(3)若用蒸馏水将该氨水稀释10倍后pH=a,则a的取值范围为 , 的值 (填“增大”、“不变”或“减少”)。
的值 (填“增大”、“不变”或“减少”)。
(4)若向该氨水中逐滴加入等浓度的盐酸,溶液中pH与pOH(pOH=-lg[OH-])的变化关系如右图所示,A点所示溶液的导电能力 (填“大于”、“等于”或“小于”)D点,B点所加盐酸的体积(填“大于”、“等于”或“小于”)100mL,C点溶液呈酸性的原因是(用离子方程式表示) 。
已知A 的产量可以用来衡量一个国家石油工业发展的水平。现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。回答下列问题(对应有机物请书写结构简式):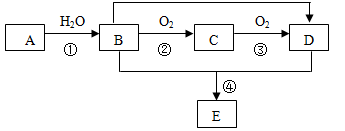
(1)C的结构简式为 ;B的官能团名称为 ;
(2)A通入溴水中的反应现象为 。
(3)反应④的化学方程式为 ,反应类型为 。
(4)由A作单体合成高分子化合物的化学方程式为 ;
(5)写出属于酯类的E的所有同分异构体(不包括E)的结构简式为 。
海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: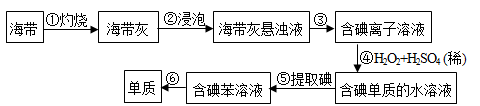
回答下列问题:
(1)步骤①灼烧海带时,除需要酒精灯、三脚架和坩埚钳外,还需要用到的实验仪器有 。
(2)步骤③的实验操作名称是 。
(3)步骤④反应的离子方程式是 。碘有极其重要的生理作用,缺乏碘会引起很多疾病。我国在居民食用盐中加入了一定量的含碘物质________以确保人体对碘的摄入量。
| A.I2 | B.KI | C.KIO3 | D.KIO4 |
(4)设计一种检验提取碘后的水溶液中是否还含单质碘的简单方法 。
在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
| 反应物 |
催化剂 |
温度 |
|
| ① |
10mL10% H2O2溶液 |
无 |
25℃ |
| ② |
10mL20% H2O2溶液 |
无 |
25℃ |
| ③ |
10mL20% H2O2溶液 |
无 |
40℃ |
| ④ |
10mL20% H2O2溶液 |
1~2滴0.1mol/LFeCl3溶液 |
40℃ |
通过实验得到氧气的体积与时间的关系如右图所示,
回答下列问题: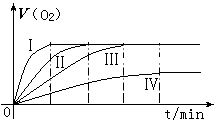
(1)代表实验①的图示是 。
(2)对比实验③和④的目的是 。
(3)通过上面对比实验,所得的实验结论是 。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3 mol H2,一定条件下发生反应:N2(g)+3H2(g)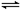 2NH3(g),测得其中N2物质的
2NH3(g),测得其中N2物质的 量随时间变化如图所示。回答下列问题:
量随时间变化如图所示。回答下列问题: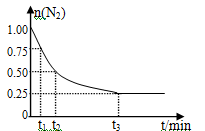
(4)从开始反应到t2时刻,氨气的平均反应速率为 。
(5)在t3时刻,氢气的转化率为 。