已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |
胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kP a时,lmol H2完全燃烧生成液态水,放出2
a时,lmol H2完全燃烧生成液态水,放出2 85.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3kJ的热量。下列热化学方程式书写正确的是()
85.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3kJ的热量。下列热化学方程式书写正确的是()
| A.2H2(g)+ O2(g)=2H2O(1);△H=-285.8kJ/mol |
B.CH4(g )+2 O2(g)=CO2(g)+2H2O(1);△H=-890.3kJ/mol )+2 O2(g)=CO2(g)+2H2O(1);△H=-890.3kJ/mol |
| C.CH4(g)+2 O2(g)=CO2(g)+2H2O(g);△H=-890.3kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H=+890.3kJ/mol |
运用元素周期律分析以下说法,其中正确的是()
| A.原子半径:K>Na>Al |
| B.非金属性:N>O>F |
| C.稳定性:HF<HCl<HBr |
| D.碱性:NaOH<Mg(OH)2<Al(OH)3 |
下列做法不能体现低碳生活的是()
| A.减少食物加工过程 | B.大力提倡使用太阳能 |
| C.直接使用薪柴为燃料 | D.尽量购买本地的、当季的食物 |
下列实验设计及其对应的离子方程式均正确的是
| A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+="=" Cu2+ + 2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2Na+ + 2OH- + O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2 + H2O= H+ + Cl- + HClO |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO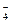 + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
下列实验过程中产生的现象与对应的图形符合的是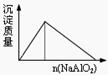
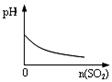
| A.盐酸溶液中加入NaAlO2; | B.SO2气体通入溴水中 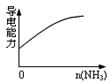 |
| C.pH=2的醋酸与盐酸溶液分别加水稀释 | D.氨气通入醋酸溶液中 |