(共8分)
(1)2.00g C2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,请写出表示C2H2燃烧热的热化学方程式: ;
(2)C2H2可用于制作燃料电池,请写以KOH溶液为电解质溶液的乙炔燃料电池的负极反应式: ;
(3)用乙炔燃料电池电解AgNO3溶液,用石墨做电解池两极,请写出与电源负极相连的石墨电极的电极反应式: ;
(4)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O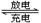 3Zn(OH)2 + 2Fe(OH)3 + 4KOH。请写出该电池在充电时阴极的电极反应式: ;
3Zn(OH)2 + 2Fe(OH)3 + 4KOH。请写出该电池在充电时阴极的电极反应式: ;
A~F六种有机物的相互转化关系如图所示: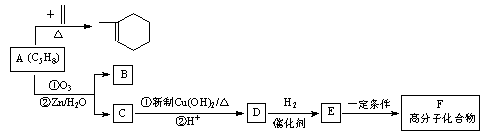
已知 :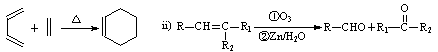
据此回答下列问题:
(1)A是合成天然橡胶的单体,用系统命名法命名,A的名称为,天然橡胶的结构简式为_。
(2)A生成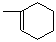 时,A发生的反应类型为。
时,A发生的反应类型为。
(3)E→F的化学方程式为。
(4)A与Br2按物质的量比1∶1发生加成反应,生成的产物有_种(考虑顺反异构)。
(5)现有另一种有机物G,已知G与E无论按何种比例混合,只要总质量一定,完全燃烧时生成的CO2、H2O以及消耗的O2均为定值。请写出两种符合下列要求的G的结构简式_、。
①M(G)<M(E);
②G的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶3。
按要求填写下列空白
(1)含有一个手性碳原子且式量最小的单烯烃的结构简式。
(2)若分子式为C4H6的某烃中所有的碳原子都在同一直线上,则该烃的结构简式_。
(3)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为。
(4)不能使酸性高锰酸钾溶液褪色的相对分子质量最小的苯的同系物的结构简式_。
“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是重要举措之一。以下两种兴奋剂的结构分别为:
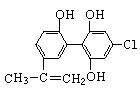
①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是
| A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰 |
| B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 |
| C.两种兴奋剂最多都能和含3molNaOH的溶液反应 |
| D.两种分子中的所有碳原子均不可能共平面 |
煤和石油是重要的能源,也是化工生产的重要原料。
(1)工业上分馏石油的设备是________,通过该设备制备出的液体燃油有__________________________。
(2)使用催化剂进行石油裂化及裂解获得的主要产品是_____________________________。
(3)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_______ _____________________。
(4)下图是对煤燃烧产生的废气进行常温脱硫处理的流程示意图。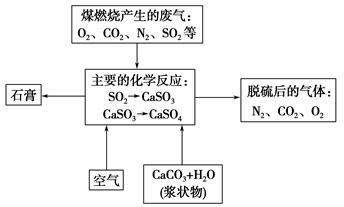
①废气脱硫过程中,主要反应的化学方程式为__________________________、__________________________。
②在煤中直接添加一种物质,可有效减少煤燃烧产生的SO2,该物质是_________________________。
③石膏在工业生产中的用途是________(写出一种用途即可)。
(5)煤经过________(填加工方法)可以得到炉煤气、煤焦油和焦炭。煤焦油经过________(填加工方法)可得到芳香族化合物。煤也可以用氢化法转化成燃油,氢化法的本质是___________________________。
水处理技术在生产、生活中应用广泛。
(1)含有较多________离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为____________(写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过________(填“RH”或“ROH”)型离子交换树脂,原因是__________________________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为____________。电渗析法净化水时,使离子通过半透膜的推动力是__________。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的__________。