锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量为世界第一,从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe Sb4O6+6FeS②Sb4O6+6C
Sb4O6+6FeS②Sb4O6+6C 4Sb+6CO↑,关于反应①、②的说法正确的是( )
4Sb+6CO↑,关于反应①、②的说法正确的是( )
A.反应①②中的氧化剂分别是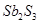 、 、 |
| B.反应②说明高温下C的还原性比Sb强 |
| C.反应①中每生成1mol FeS时,共转移3mol电子 |
| D.每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |
能在溶液中大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,下列各组离子没有明显减少的是
| A.Na+、H+、Cl-、NO3- | B.K+、Ba2+、OH-、I- |
| C.Na+、Mg2+、C1-、SO42- | D.Cu2+、S2-、Br-、C1O- |
下列关于物质性质及用途的叙述中,正确的是
| A.铜在潮湿的空气里很稳定不会被锈蚀 |
| B.二氧化硅可用来制造现代通迅材料光导纤维 |
| C.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2 |
| D.硅是应用广泛的半导体材料,常温下只与F2、HF反应不和其它任何物质反应 |
下列用来表示物质变化的化学用语中,正确的是
| A.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- |
| B.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2 ↑ |
| C.表示乙炔“燃烧热”对应的热化学方程式: C2H2(g)+  O2(g)=2CO2(g)+H2O(g) ?△H=-1 256 kJ/mol O2(g)=2CO2(g)+H2O(g) ?△H=-1 256 kJ/mol |
| D.M与N是同素异形体,由M=N△H=+119 kJ/mol可知,N比M稳定 |
下列关于能源和作为能源使用的物质的叙述中错误的是
| A.太阳能电池利用太阳能的方式是光—电转换 |
| B.生物质能本质上是太阳能 |
| C.寻找高效催化剂,使水分解出产物氢气,同时释放能量 |
| D.利用太阳能、风能和氢能等能源替代化石能源可以改善空气质量 |
下列四组溶液其中可用稀硫酸进行鉴别的一组是
| A.BaCl2溶液、Ba(NO3)2溶液、Na2CO3溶液 |
| B.NaCl溶液、Ba(NO3)2溶液、Na2CO3溶液 |
| C.KCl溶液、 Ba(NO3)2溶液、MgCl2溶液 |
| D.NaCl溶液、K2CO3溶液、Na2CO3溶液 |