综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
A.可在酸性氧化物中寻找 B.可在碱性氧化物中寻找
C.可在ⅠA、ⅡA族元素形成的氧化物中寻找 D.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A: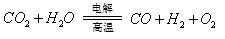 已知:
已知: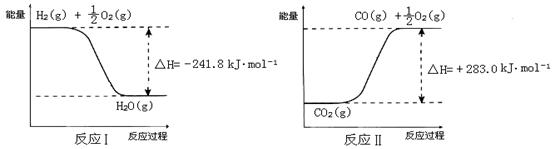
① 反应Ⅱ是_____反应(填“吸热”或“放热”)。
② 反应A的热化学方程式是 。
(4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3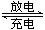 Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则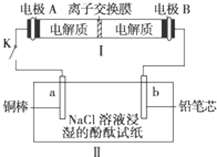
①负极反应式为:
②当有0.02 mol Na+通过离子交换膜时,b电极上析出的气体体积为 mL
③闭合K后,b电极附近的pH (填变大、变小或不变);
同时a电极反应式为
按要求书写离子方程式:
(1)四氧化三铁溶于稀硝酸的化学方程式:___________________________________________
(2)偏铝酸钠溶液中通入过量CO2的离子方程式:_____________________________________
(3)制备漂白粉的化学方程式:_____________________________________________________
(4)氯仿与氯气在光照条件下反应的化学方程式:_____________________________________
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是。
(2)将2.4mol某金属投入某酸溶液中,恰好完全反应,并产生7.2g氢气,则此金属化合价为。
(3)某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下:
| 实验次数 项目 |
第一次 |
第二次 |
第三次 |
| 所取合金的质量/g |
20 |
20 |
40 |
| 所加稀硫酸的质量/g |
100 |
120 |
80 |
| 生成氢气的质量/g |
0.4 |
0.4 |
0.4 |
①该合金中铁的质量分数是%(结果精确到1%)。
②本实验中所加稀硫酸的溶质的质量分数为%(结果精确到0.1%)。
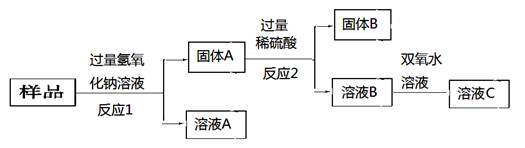
由Fe、CuO、C、Al组成的混合粉末,取样品进行下列实验(部分产物略去):
(1)反应1中的化学方程式是:;
(2)反应2中的离子方程式是:。
(3)当溶液B变成溶液C时双氧水变成了水,请完成该反应的离子方程式:
(配平的化学计量数写在方框内,若计量数为“1”也要写出来)□ Fe2++ □ H2O2+ □ H+ = □ Fe3++ □ H2O
此该反应的还原剂为。
(4)已知固体B与浓硫酸共热可以产生两种气体,若反应后硫酸变成SO2,则1.5mol硫酸完全反应转移的电子数为mol。
(1)把暴露在空气中一段时间的金属钠分为两份:一份投入足量水中;另一份放在坩埚中灼烧,再把灼烧后坩埚里的固体物质投入到足量的水中。请分析整个过程中可能发生的化学反应,并按下列要求填写。
①若是非离子反应的请写出化学方程式
②若是离子反应的请写出离子方程式
(2)钙和氢气在一定温度下可化合生成一种灰白色的化合物A,A是一种金属氢化物。取少量A投入水中,剧烈反应并产生一种无色无味易燃气体,同时形成一种碱溶液。请写出化合物A与水反应的化学方程式,并用单线桥标出该反应中电子转移的情况:。
(18分)某化学学习小组用某种粗盐进行提纯实验,步骤如下图所示:
已知粗盐中含有的杂质离子主要为:K+、Mg2+、Ca2+、Fe3+、SO42-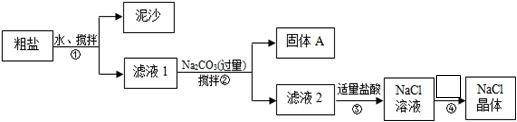
(1)步骤①和②的操作名称是,所需要玻璃仪器为
(2)步骤②中在加入Na2CO3溶液之前还需加入过量NaOH溶液和BaCl2溶液
固体A是:、BaCO3。(用化学式表示)
请写出步骤②中加入NaOH溶液所发生的离子反应(用离子方程式表示):
(3)步骤②中检验SO42-沉淀完全的操作是:
(4)步骤③中加入盐酸的作用是(用离子方程式表示)
(5)步骤④的操作为:、过滤;其中第一步操作所需仪器有:三脚架、玻璃棒、。