工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
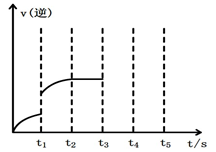
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
| A.2v(H2)(逆) =v(CO)(正) | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。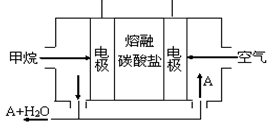
査尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下: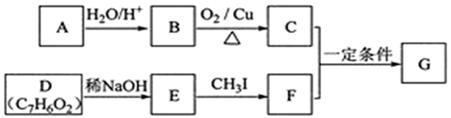
已知以下信息:
① 芳香烃A的相对分子质量在100 ~110之间,1
充分燃烧可生成72
水。
② C不能发生银镜反应。
③ D能发生银镜反应、可溶于饱和
溶液、核磁共振氢谱显示有4种氢。
④ 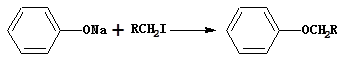
⑤
回答下列问题:
(1)
的化学名称为。
(2)由
生成
的化学方程式为。
(3)
的分子式为,由
生成
的反应类型为。
(4)
的结构简式为。
(5)
的芳香同分异构体
既能发生银镜反应,又能发生水解反应,
在酸催化下发生水解反应的化学方程式为。
(6)
的同分异构体中,既能发生银镜反应,又能与
溶液发生显色反应的共有种,其中核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的为(写结构简式)。
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态
原子中,电子占据的最高能层符号为,该能层具有的原子轨道数为、电子数为。
(2)硅主要以硅酸盐、等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子。
(4)单质硅可通过甲硅烷(
)分解反应来制备。工业上采用
和
在液氨介质中反应制得
,该反应的化学方程式为。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |
||||||
| 键能/( | 356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是。
②
的稳定性小于
,更易生成氧化物,原因是
(6)在硅酸盐中
4四面体(如下图(
))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(
)为一种无限长单链结构的多硅酸根,其中
原子的杂化形式为
与
的原子数之比为化学式为。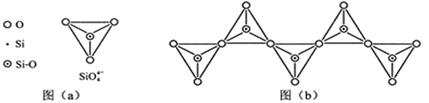
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下: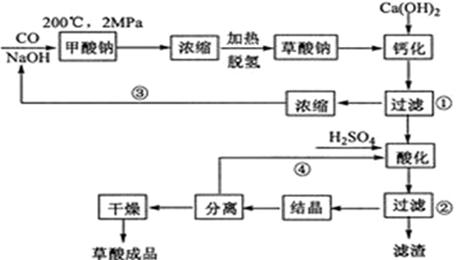
回答下列问题:
(1)
和
在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为、。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是,滤渣是;过滤操作②的滤液是和滤渣是。
(3)工艺过程中③和④的目的是。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500
的酸性
溶液滴定,至粉红色不消褪,消耗
溶液15.00
,反应的离子方程式为;列式计算该成品的纯度。
二甲醚(
)是无色气体,可作为一种新型能源。由合成气(组成为
、
和少量的
)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)
+ 2
=
= -90.1
•
(ii) + 3 = + = -49.0 •
水煤气变换反应:
(iii)
+
=
+
= -41.1
•
二甲醚合成反应:
(iV)2
=
+
= -24.5
•
回答下列问题:
(1)
是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度
的主要工艺流程是(以化学方程式表示)。
(2)分析二甲醚合成反应(iV)对于
转化率的影响。
(3)由
和
直接制备二甲醚(另一产物为水蒸气)的热化学方程式为。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响。
(4)有研究者在催化剂(含
-
-
-
和
)、压强为5.0
的条件下,由
和
直接制备二甲醚,结果如下图所示。其中
转化率随温度升高而降低的原因是。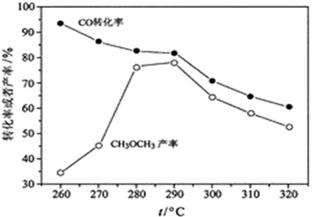
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93
•
•
)。若电解质为酸性,二甲醚直接燃料电池的负极反应为,一个二甲醚分子经过电化学氧化,可以产生个电子的能量;该电池的理论输出电压为1.20
,能量密度
=(列式计算。能量密度=电池输出电能/燃料质量,1
•
= 3.6×106
)。
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(
)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为
。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
回答下列问题:
(1)
中,
元素的化合价为。
(2)写出"正极碱浸"中发生反应的离子方程式。
(3)"酸浸"一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式;可用盐酸代替
和
的混合液,但缺点是。
(4)写出"沉钴"过程中发生反应的化学方程式。
(5)充放电过程中,发生
与
之间的转化,写出放电时电池反应方程式。
(6)上述工艺中,"放电处理"有利于锂在正极的回收,其原因是。在整个回收工艺中,可回收到的金属化合物有(填化学式)。