已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) k J的热量。
目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)在离子交换膜法电解饱和食盐水过程中,与电源正极相联的电极上所发生反应为__________,与电源负极相连的电极附近溶液的pH__________(选填“不变”“升高”“降低”)。
(2)如果粗盐中SO42-含量较高,必须添加试剂除去SO42-,则按添加试剂顺序,依次发生反应的离子方程式为______________________________。
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________.冷却.__________(填写操作名称)除去NaCl。
(4)现有阳离子交换膜.阴离子交换膜.石墨电极和如下图所示电解槽,用氯碱工业中的离子交换膜技术原理,可通过电解电解饱和Na2SO4溶液的方法生产NaOH溶液和H2SO4溶液.则电极c为__________极(填“正”.“负”.“阴”.“阳”),b为__________离子交换膜(填“阴”.“阳”)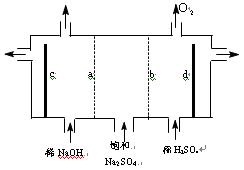
如图所示的转化关系中,已知A是由短周期元素组成的酸式盐。D.Y.H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。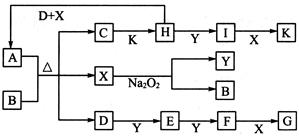
请回答下列问题:
(1)用电子式表示X的形成过程:____________________。
(2)写出D.H.X反应生成A的离子反应方程式:____________________。
(3)已知:2H(g)+Y(g) 2I(g);
2I(g); 。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
A.40% B.50% C.80% D.90%
(4)标准状况下在1000mL某密闭容器中装有440mL的C溶液,向其中加入3.9g Na2O2充分反应后恢复至原温度,发现容器内气体压强变为原来的1.5倍(忽略溶液体积变化),则原C溶液的物质的量浓度为__________mo1·L-1。(保留两位有效数字)
[化学—选修有机化学基础].
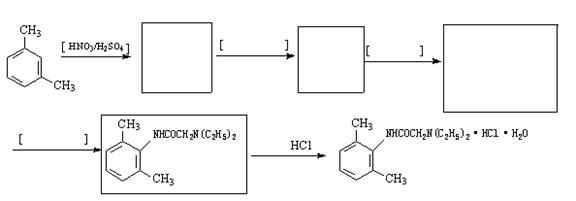
雷诺嗪是治疗慢性心绞痛首选新药。雷诺嗪合成路线如下:
(1)雷诺嗪中含氧官能团,除酰胺键(-NHCO-)外,另两种官能团名称:____、____。
(2)写出满足下列条件A的同分异构体的数目____。
①A能与FeCl3溶液发生显色反应;②1molA可与2molNaOH反应。
(3)C→D中,加入适量NaOH的作用是:____________。
(4)从雷诺嗪合成路线得到启示,可用间二甲苯、ClCH2COCl、(C2H5)2NH(无机试剂任用)合成盐酸利多卡因,请在横线上补充反应物,在方框内补充生成物。
已知: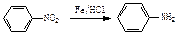
[化学—选修物质结构与性质]
美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右: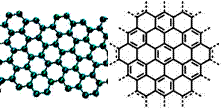
(1)下列有关石墨烯说法正确的是____。
| A.石墨烯的结构与金刚石相似 |
| B.石墨烯分子中所有原子可以处于同一平面 |
| C.12g石墨烯含σ键数为NA |
| D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力 |
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。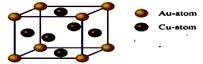
①钴原子在基态时,核外电子排布式为:____________。
②乙醇沸点比氯乙烷高,主要原因是____________。
③上图是金与铜形成的金属互化物合金,它的化学式可表示为:________。
④含碳源中属于非极性分子的是___(a.甲烷 b.乙炔 c.苯 d.乙醇)
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:________。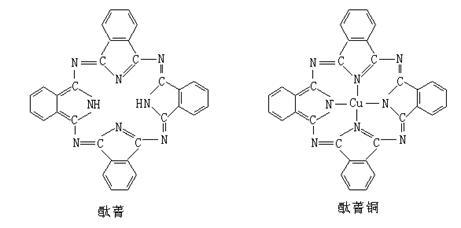
[化学—选修化学与技术]请回答有关氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=____(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是________(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中X、Y分别是____、____(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:____;负极:____;③这样设计的主要节(电)能之处在于(写出2处)________、________。