某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32―、Cl一、SO42―,为确认溶液的组成,现取100 mL分成三等份溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58 g,同时收集到气体0.03 mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99 g。
由此可知,下列关于原溶液组成的正确结论是( )
| A.溶液中SO42―的浓度是0. 3 mol/L | B.溶液中一定含有A13+和NH4+ |
| C.一定不存在Mg2+,可能存在A13+ | D.一定存在Cl一 可能含CO32— |
(8分)用下面的原子或离子结构示意图的编号(A、B、C、D)填空: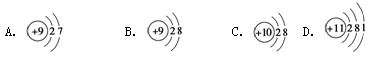
(1)核外电子层排布相同的是__________和___________;
(2)属于同种元素的是__________和__________;
(3)属于金属元素的是____________________;
(4)写出D参加化学反应后所得离子的结构示意图___ ____。
铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色沉淀,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为___________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
(1)元素M 的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为 。
(2)硫酸铝溶液与过量氨水反应的离子方程式为 。
(3)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是 (填序号)。
HSO3-+OH-水解平衡的事实是 (填序号)。
A.滴人酚酞溶液变红,再加人H2SO4溶液后红色退去
B.滴人酚酞溶液变红,再加人氯水后红色退去
C.滴人酚酞溶液变红,再加人BaCl2溶液后产生沉淀且红色退去
(4)元素X、Y在周期表中位于向一主族,化合物Cu2X和Cu2Y 可发生如下转化(其中D 是纤维素水解的最终产物):
①非金属性X Y(填“>”或“<”)
②Cu2Y与过量浓硝酸反应有红棕色气体生成,化学方程式为 。
(5)在恒容绝热(不与外界交换能量)条件下进行2A ( g ) + B ( g) 2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
| 物质 |
A |
B |
C |
D |
| 起始投料/mol |
2 |
1 |
2 |
0 |
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO₃²﹣):n(HSO₃﹣) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,用化学平衡原理解释: 。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
已知:I2+2

 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________________;
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是_______________。(用化学方程式表示)。由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是_______。
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示荆,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2•2H2O的质量百分数为___________________________。