钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的实验流程图: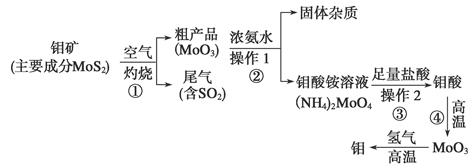
(1)钼酸铵溶液中阳离子的检验方法:________________________________________。
(2)写出反应①的化学方程式:______________________________________________。
(3)反应①的尾气可以用NH3·H2O溶液吸收用于合成肥料,写出反应的离子方程式
______________________________________________________________________。
(4)工厂排放的废水中,金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。处理时首先在酸性条件下用H2O2将Cr3+转化为Cr2O ,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2生成CrOH(H2O)5SO4沉淀。
,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2生成CrOH(H2O)5SO4沉淀。
①H2O2的作用是将溶液中的Cr3+转化为Cr2O ,写出此反应的离子方程式:______________。
,写出此反应的离子方程式:______________。
②常温下,部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
— |
— |
— |
| 完全沉淀时的pH |
3.7 |
11.1 |
8(>9溶解) |
9 |
加入NaOH溶液使溶液呈碱性,Cr2O 转化为CrO
转化为CrO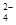 。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
③写出上述过程中用SO2作还原剂进行还原的离子方程式______________________。
某同学按如下实验流程提取海带中的碘,请回答相关问题。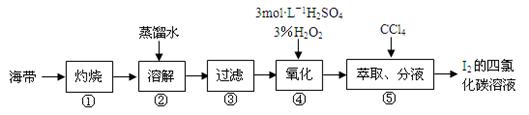
 (1)第①步是将海带放入______________(填仪器名称)中,用酒精灯充分加热灰化。
(1)第①步是将海带放入______________(填仪器名称)中,用酒精灯充分加热灰化。
(2)第②步为了加快溶解速度并使碘离子充分进入溶液,可以采取的措施是____________
_______________________________________(写出两条)。
(3)实验进行到某一步骤时应检验碘的存在,具体方法是___________________。
(4)海带灰中还含有其他无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第_________步(填编号)与碘分离的。
(5)在实验过程中,需要配制250mL3mol·L-1H2SO4溶液,在配制250mL3mol·L-1H2SO4溶液时,某同学转移溶液的操作如右图所示,图中的主要错误是: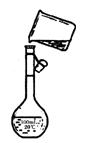
①;
②。
(19分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。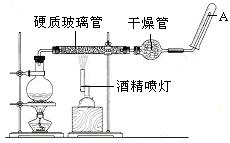
(1)写出该反应的化学方程式,其中氧化剂是,还原剂是。8.4g铁粉参加反应,转移电子mol。
(2)玻璃管中石棉绒的作用是,实验开始时应先点燃,实验结束时应先熄灭。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶里应事先放置,其作用是。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的
成分是,若溶液未变红色则说明硬质试管中固体物质的
成分是。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是
(用离子方程式表示)。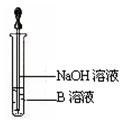
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按上图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关
的反应的化学方程式,
。
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是,
并且配制含Fe2+的盐溶液时应加入少量。
(10分)在实验室里,某同学取一小块金属钠做与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是,所发生反应的化学方程式是。
(2)将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是
①,②。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是
| A.有气体生成 | B.钠融化成小球并在液面上游动 |
| C.溶液底部有银白色的金属钙生成 | D.溶液变浑浊 |
(3)钠与水反应的离子方程式为。
在反应过程中,若生成标准状况下224mL的H2,则转移的电子的物质的量为。
(4)根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是
。
肉桂醛在食品、医药化工等方面都有重要应用。
(1)下列是合成肉桂醛、制备肉桂酸的反应路线: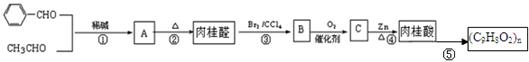

实验表明:
Ⅰ. A既能发生银镜反应,又能与金属钠反应放出氢气;
Ⅱ. 肉桂醛的相对分子质量不超过140,其中碳氢元素质量分数为87.89%。
Ⅲ. 核磁共振氢谱表明肉桂醛分子中有六种氢,其峰面积之比为1:1:1:2:2:1;
(1)A中含有的官能团为
(2) 请写出肉桂醛的结构简式。
————————————————————————————
(3) 已知反应①的原子利用率为100%,请写出第①步的化学反应方程式。
(4)反应(1)的反应类型反应(2)的反应类型为
(5) 请写出上述合成路线中使用③④两步反应的目的。
(6)写出反应⑤的化学方程式。
(7) 请写出与肉桂醛互为同分异构体,且同时满足 a.分子中无甲基,b.所有碳原子一定在同一平面上c、苯环上一氯代物只有两种的有机物的结构简式。
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度 越大。
越大。
H2CO3
 + H+ Ka1(H2CO3)=4.45×10—7
+ H+ Ka1(H2CO3)=4.45×10—7

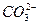 +H+ Ka2(HCO3-)=5.61×10-11
+H+ Ka2(HCO3-)=5.61×10-11
HclO  H++
H++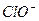 Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,
有少量气泡产生,溶液浅黄绿色褪去;
② 过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③ 为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
① 反应后所得的溶液漂白性增强的原因是_____________________
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有_______。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液 面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。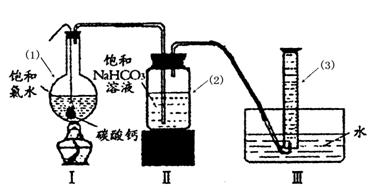
请回答:
③写出仪器(1)与仪器(3)的名称
(1)(3)
④为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是。
⑤如何准确读出量筒中气体的体积
a_________
b 上下移动量筒至量筒内液面与水槽液面相平
c