( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状 态I, 反应在绝热条件下达到平衡时处于状态II(如下图),则该反应的△H 0; ( 填:“< ,> , = ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状 态I, 反应在绝热条件下达到平衡时处于状态II(如下图),则该反应的△H 0; ( 填:“< ,> , = ”)。该反应在 (填:高温或低温)条件下能自发进行。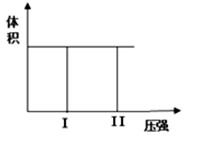
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式: 。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,
A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa
和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
在一定条件下,乙烷和乙烯都能制备氯乙烷(C2H5Cl)。试回答:
⑴用乙烷制备氯乙烷的化学方程式是,反应类型是;
⑵用乙烯制备氯乙烷的化学方程式是,反应类型是;
⑶上述两种制备乙烷的方法中,方法好(填1或2)。原因是
____。
某温度下,在一固定容积的容器中进行如下反应N2+3H2 2NH3,下列情况一定能说明反应已达到限度的是:。(填序号)
2NH3,下列情况一定能说明反应已达到限度的是:。(填序号)
① 容器内气压不随时间变化 ② 1个N≡N键断裂的同时,有6个N—H键断裂
③用N2、H2、NH3的物质的量浓度变化表示化学反应速率的比为1:3:2。
④ 容器内气体密度不再改变 ⑤ 混合气的平均相对分子质量不随时间变化
化合物A是一种不稳定的物质,它的分子组成可用 表示,10mL A气体能分解生成15 mL
表示,10mL A气体能分解生成15 mL 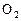 和10mL
和10mL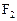 (同温同压下)
(同温同压下)
(1)A的分子式___________________;
(2)已知A分子中X个氧原子是…—O—O—O—…链状排列,则A分子的电子式____________________,结构式是_____________________。
下表是元素周期表的一部分:
族 |
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
||
| 2 |
② |
③ |
④ |
⑤ |
⑥ |
||||
| 3 |
⑦ |
⑧ |
⑨ |
⑩ |
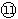 |
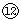 |
(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素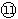 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱)
(2)某元素的原子结构示意图为: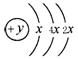 ,在周期表位于 。该
,在周期表位于 。该
氢化物沸点比甲烷 (填高或低)。
(3)用电子式表示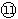 与⑧形成化合物形成过程: 。
与⑧形成化合物形成过程: 。
(4)写出⑦与⑨、⑨与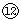 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式:
⑦与⑨: 、⑨与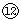 。
。
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
(1)电解质溶液为稀H2SO4时,灯泡_______(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为: ____
Al电极上发生的反应为:____________
b.若灯泡不亮,其理由为:____________________________
(2)电解质溶液为NaOH(aq)时,灯泡__________
(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:________
Al电极上发生的反应为:。
b.若灯泡不亮,其理由为:___________ ________。