下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 氢化物的沸点(℃) |
-60.7 |
-33.4 |
-111.5 |
100 |
-87.7 |
19.54 |
-84.9 |
-161.5 |
| 最高化合价 |
+6 |
+5 |
+4 |
|
+5 |
|
+7 |
+4 |
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是 (用表中元素编号填写)。
写出H的最高价氧化物的结构式: 。
(2)比较A、D、G三种简单阴离子的半径大小:r( )>r( )>r( )(均用实际的元素符号表示)。比较元素F、G的氢化物的沸点高低,并说明理由 。
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是: 。
(5)以下说法正确的是 (填编号)。
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现
d.BD2-的钠盐、G-的钠盐的外观及其相似,鉴别它们可以用酸性高锰酸钾溶液、酸性碘化钾淀粉溶液,也可以通过检测两溶液的pH值来鉴别
(4分)现有
| A.二氧化硅 | B.三氧化二铁 | C.二氧化硫 | D.三氧化二铝。 |
请你根据已有的知识,选择合适的物质,用字母代号填空:
(1)能形成酸雨的是;(2)光纤制品的基本原料;
(3)属于两性氧化物的是;(4)红棕色固体是。
(11分下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟生成E,A是强碱,D是海水中浓度最高的盐(部分反应物和生成物及水已略去)。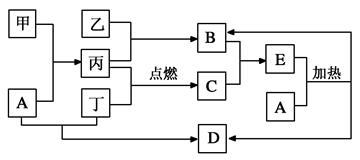
请回答下列问题:
(1)写出乙与丙生成B的化学方程式:________________________________________。
(2)写出甲和A溶液反应的离子方程式:_______________________________________。
(3)检验E中的阳离子时,取少量E于试管中,________________则证明E中有该阳离子。
(4)写出实验室制取B的化学方程式:______________________________________。
(5)B常用作工业制某酸的原料,写出由B制该酸过程中的化学方程式:
________________________________________________________。
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为: KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氧化钠辖液电解实验,如图所示。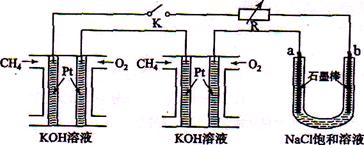
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为、。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是,电解氯化钠溶液的总反应方程式为;
(3)若每个电池甲烷通如量为1 L(标准状况),且反应完全,则理论上最多能产生的氯气体积为L(标准状况)。
一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、I-,取该溶液进行以下实验:
a.用pH试纸测得该溶液呈酸性;
b.取部分溶液,加入数滴新制的氯水及少量CCl4,经振荡、静置后,CCl4层呈紫红色;
c.另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,在整个滴加过程中无沉淀生成;
d.取部分上述碱性溶液,加入Na2CO3溶液,有白色沉淀生成,
e.将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:
①写出b所发生反应的离子方程式;
②该溶液中肯定存在的离子是;
③该溶液中肯定不存在的离子是。