砷(As)广泛分布于自然界,其原子结构示意图是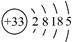 。
。
(1)砷位于元素周期表中 族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。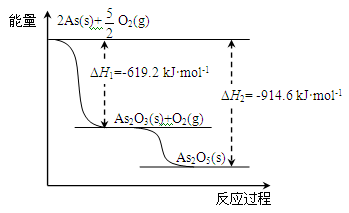
(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+ AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。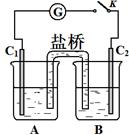
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3
的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针
向右偏转。此时C2上发生的电极反应是 。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH
溶液,可观察到电流计指针 (填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
① 将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。As2O5与NaOH溶液反应的离子方程式是 。
② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g。
在氮化硅中添加氧化铝,用氧原子取代一部分氮,用铝原子取代一部分硅,通过常压烧结即成为新一代无机非金属材料,叫氧氮化硅铝,即赛伦(Sialon),化学通式为Si6-xAlxOxNy(x:2~4)。
(1)判断赛伦属于晶体类型,并且有等特性(至少写出三种)。
(2)化学通式里y值为(用含x的表达式或某一具体数值表示)。
1985年,科学家发现C60分子是由60个碳原子构成的,它的形状像足球(图C),因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,它是由六边环形的碳原子构成的管状大分子(图D),图A、图B分别是金刚石和石墨的结构示意图。图中小黑点或小黑圈均代表碳原子。
试回答下列问题:
(1)金刚石、石墨、足球烯和碳纳米管物理性质存在较大差异的原因是 。
(2)常温下足球烯和碳纳米管的化学性质是否比金刚石和石墨活泼?____________(填“活泼”和“一样”)理由是 。
(3)由下边石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C原子数与C—C键数之比为 。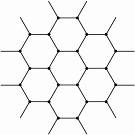
(4)在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上有_____(填数字)个碳原子,每个碳原子上的任两个C—C键的键角都是 (填角度)。
(5)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决制得H2后的贮存问题,在上述四种碳单质中有可能成为贮氢材料的是 。
A、B、C、D是按原子序数由小到大排列的第2、3周期的元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下(图中部分产物未列出):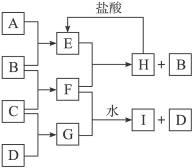
请填写下列空白:
(1)A是______________________,C是______________________。
(2)H与盐酸反应生成E的化学方程式是______________________________________。
(3)E与F反应的化学方程式是______________________________________________。
(4)F与G的水溶液反应生成I和D的离子方程式是____________________________。
在右图中填上元素周期表中与硅上下相邻、左右相邻的元素符号,并完成下列问题:
(1)其中最高价氧化物对应的水化物酸性最强的元素是_________,酸的化学式为______________。
(2)硅酸的酸性比_____________、_____________强,比_____________、____________弱。
在电弧作用下使石墨蒸发,在真空中冷凝,得到空心球状分子,其相对分子质量分别为720和840,写出这两种分子的化学式:____________和___________。它们与石墨的关系是_____________;其中一种分子可与金属钾形成超导化合物,该物质的相对分子质量为837,则此化合物的化学式为______________。