现有下列九种物质:①蔗糖(C12H22O11)、②熔融NaCl、③NaCl溶液、④铝、⑤氢氧化钡、⑥液氧(O2)、⑦硫酸铜、⑧酒精(C2H6O)、⑨H2SO4
(1)在以上物质中,属于电解质的是 (填写序号)。
(2)从上述物质中选出两种物质作为反应物,写出一个符合下列反应类型的化学方程式:
①化合反应 ;
②置换反应 ;
③复分解反应 ;
④有非电解质参与反应的氧化还原反应 。
(4分)某化合物2.3g在足量的氧气中充分燃烧,只生成了4.4g CO2和2.7gH2O。该化合物的相对分子质量是氢气相对分子质量的23倍。该化合物的分子式为________________;若该化合物的1H核磁共振谱只有一个信号峰,则其结构简式为________________。
(6分)某有机物A结构如下: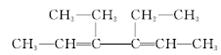
(1)用系统命名法对其命名:_____________________________________________
若该烃完全氢化后再与氯气光照下进行反应,其一氯代物有______种。
(2)烃B与烃A是同分异构体,能使酸性高锰酸钾溶液和溴水褪色,其一氯取代物只有一种结构,烃B的结构简式可以为_______________________________
(8分)已知某有机物的相对分子质量为58,请回答:
(1)若该有机物为烃,且含有支链,则其结构简式为____________________________
(2)若为结构中只含1个-CH3和一个官能团的含氧衍生物,则官能团的名称为_______
(3)若为结构中有2个 — CH3含氧衍生物,则可能的结构简式为_________________
(4)若分子中有 — OH,无C=O键,则结构简式为_____________________________
(10分)有A、B两种烃,相关信息如下:
| A |
① 28< M(A) < 60 ②不能使溴的四氯化碳溶液褪色 ③其一氯取代物只有一种 ④完全燃烧产物中CO2和H2O物质的量之比2:1 |
| B |
①饱和链烃,通常情况下呈气态 ②有同分异构体 ③其二溴取代物有三种 |
回答下列问题:
(1)烃A的最简式_____________,结构简式____________________
(2)烃B同一碳原子上的二溴取代物的结构简式______________________
(3)烃C为烃B的同系物,其碳原子数大于B但小于10,其一溴取代物只有一种,该烃的系统命名法名称可能为________________________________________________。
(6分)(1)1mol某烃A与1mol H2起反应生成1mol乙苯,该加成反应的化学方程式为:
_________________________________________________________;
烃A发生加聚反应的化学方程式为____________________________________;
(2)写出60℃时1,3—丁二烯与溴1:1反应的方程式_________________________