一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=  ,请回答下列问题:
,请回答下列问题:
(1)该反应的化学方程式为___________________________________;若温度升高,K增大,则该反应是____反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是__________(填字母序号)。
| A.υ正(H2O)=υ逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗nmolH2的同时消耗nmolCO |
| D.容器中物质的总物质的量不随时间改变 |
(3)该反应的υ正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是_________________________、________________________。
下列物质中属于强电解质的是,属于非电解质是。
①CO2气体 ②FeCl3溶液 ③淀粉溶液④NH4Cl晶体 ⑤蔗糖溶液
⑥铜⑦BaSO4固体⑧CH3COOH⑨NaOH溶液⑩CCl4
写出⑧的电离方程式
⑥与上述某一物质可以发生反应,对应的离子方程式为
如何证明③是胶体?
如何检验④中的阳离子?
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
⑴火焰利用了部分金属的元素特征的反应,该反应属于(填“物理”或“化学”)变化。
⑵下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素, A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为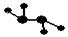 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题: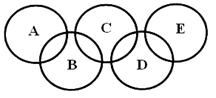
①B的水溶液呈弱酸性,是二元弱酸,其主要的电离方程式可表示为__________
D的化学式是_________。②A、B、E中均含有的一种元素为____________ (填元素名称) 。
③E电子式为____________________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸时,发生反应的化学方程式
。
⑶在实验室我国科研人员应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似。已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60分子的结构中含有_________个N—N。
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素,试回答下列问题:
| A |
R |
||||||||||||||||
| B |
C |
D |
E |
F |
T |
||||||||||||
| G |
H |
I |
J |
K |
L |
||||||||||||
| M |
N |
||||||||||||||||
(1)请写出G的淡黄色化合物与二氧化碳反应的方程式。
(2)D的气态氢化物的VSEPR模型为_,其中心原子的杂化类型为_______。
(3)G、H和I的第一电离能数值由大到小的顺序为:(用元素符号作答)。
(4)由A、C、D形成的1mol ACD分子中,含有个σ键,个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的
元素还有_______________(填元素符号),其中一种金属的晶胞结构如右
图所示,该晶胞中含有金属原子的数目为。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2
是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有____________(填分子式)。
有A、B、C、D、E 五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)写出下列元素的符号B________ C_________ E__________。
(2)由这五种元素组成的一种化合物是_______________(写化学式)。
(3)元素电负性为B_______D。(填“﹥”、“﹤”或“﹦”)