降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为 。
(2)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应
是 (填“吸热”或“放热”)反应。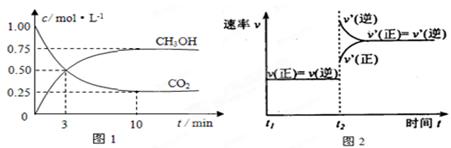
②500℃达平衡时,CH3OH的体积分数为 。
Ⅰ.已知可逆反应:M(g)+N(g)  P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;
达到平衡后,c(P)=2 mol·L-1,a=____________。
Ⅱ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应
A(g) B(g)+C(g)△H=+85.1kJ·mol-1
B(g)+C(g)△H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为。
平衡时A的转化率为_,列式并计算反应的平衡常数K 。
氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。氯碱工业中制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。学校实验小组精制粗盐水的实验过程如下: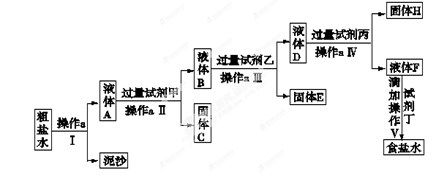
请回答以下问题:
(1)操作a的名称是,所用玻璃仪器是。
(2)在第Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为溶液。
(3)判断加入试剂乙已过量的方法是。
(4)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式。
O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为,原子个数比为,分子的物质的量之比为。
(2)等温等压下,等体积的氧气和臭氧所含分子个数比为,原子个数比为,质量之比为。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是(用含NA的式子表示)。
(4)将8 g SO3加入Χg 水中,所形成的溶液里SO42-和水分子个数之比为1:5,则Χ等于。
(5)常温常压下,14 g由N2和CO组成的混合气体中含有的原子数目为。
选择下列实验方法分离物质,将分离方法的序号填在横线上:
A 过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华 G.渗析
(1)分离水和苯的混合物;
(2)分离饱和氯化钾溶液和沙子的混合物;
(3)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(5)从碘水中提取碘单质。
某些元素的性质或原子结构信息如下表所示(每空2分,共16分).:
| A(短周期) |
B(短周期) |
C |
D(短周期) |
| 原子最外层上p电子数等于次外层电子数 |
原子最外层有两个未成对电子,其单质为人类生存必需物质 |
单质为生活中常见的金属材料,有紫红色金属光泽 |
单质是常见的半导体材料,广泛应用于IT行业 |
(1)写出A单质与浓硝酸加热反应的化学方程式:。
(2)写出B元素在周期表中的位置:,
写出C元素基态原子的电子排布式:_。
(3)写出A与D的氧化物在高温下反应的化学方程式:_。
(4)写出B、D形成的化合物与NaOH溶液反应的离子方程式:。
(5)比较A、B、D三种元素原子的第一电离能的大小(由大到小用元素符号表示)。
(6)等电子原理——原子总数相同、价电子总数相同的粒子具有相似的化学键特征,它们的许多性质是相近的。写出二种由多个原子组成的含有与N3-电子数相同的粒子 (分子离子各一种)的化学式、。这些粒子空间构型为 。