下列离子方程式正确的是
| A.向CuSO4溶液中投入Na: Cu2++ 2Na= Cu+ 2Na+ |
| B.向FeCl3溶液中滴加KSCN溶液: Fe3+ + 3SCN- = Fe(SCN)3↓ |
| C.向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2+ + HCO3- + OH- = CaCO3↓ + H2O |
| D.向BaCO3固体中加入过量的稀H2SO4:BaCO3 + 2H+= Ba2+ + CO2↑ + H2O |
工业制硫酸铜不是直接用铜和浓硫酸反应,而是将粗铜(含少量银)浸入稀硫酸中,并不断从容器下部吹入细小的空气泡。有关该制备方法的叙述中,正确的是
①该方法应用了原电池工作原理②该方法应用了电解池工作原理
③该方法不产生污染大气的二氧化硫④该方法提高了硫酸的利用率
⑤该方法提高了铜的利用率
| A.①③⑤ | B.②③ | C.①③④ | D.①③④⑤ |
可用右图装置制取(必要时可加热)、净化、收集的气体是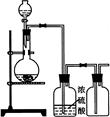
| A.铜和稀硝酸制一氧化氮 | B.氯化钠与浓硫酸制氯化氢 |
| C.锌和稀硫酸制氢气 | D.硫化亚铁与稀硫酸制硫化氢 |
已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是
| A.A13+、CH3COO—、C1— | B.Na+、NH4+、C1— |
| C.Mg2+、C1—、Fe2+ | D.Mg2+、Ba2+、Br— |
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
| A.铅笔端作阳极,发生还原反应 |
| B.铂片端作阴极,发生氧化反应 |
| C.铅笔端有少量的氯气产生 |
| D.a点是负极,b点是正极 |
下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是
| A.向水中加入少量的HCl | B.向水中加入少量的NaOH |
| C.向水中加入NaCl并加热至100℃,pH="6" | D.向水中加少量的NH4Cl |