X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是 ;Z所在周期中第一电离能最大的元素是 。
(2)XY2- 离子的立体构型是 ;R2+的水合离子中,提供孤电子 对的原子是 。
(3)Z与某元素形成的化合物的晶胞如下图所示,晶胞中阴离子与阳离子的个数比是 。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是 。
二甲苯苯环上的一溴代物有六种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别是:
| 一溴代二甲苯(℃) |
234 |
206 |
231.8 |
204 |
205 |
214.5 |
| 对应的二甲苯(℃) |
13 |
-54 |
-27 |
-54 |
-54 |
-27 |
由上述数据可推断,熔点为234℃的一溴二甲苯的结构简式是____________,熔点为-54℃的二甲苯的名称是__________________.
下列四种物质:
①3,4二甲基2乙基1戊烯  ③2,3,4三甲基戊烷 ④间甲乙苯
③2,3,4三甲基戊烷 ④间甲乙苯
其中一氯取代物个数相等的是________.
(1) 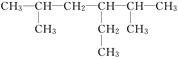 的名称是______________.
的名称是______________.
(2)2,4,6三甲基5乙基辛烷的分子中共有________个甲基原子团.
(3)分子中有6个甲基而一溴代物只有1种的烷烃的分子式是______________,其结构简式是____________,名称是________________.
对于下列芳香族化合物,命名与结构简式都正确的是( )
(1)主链含5个碳原子,有两个甲基作支链的烷烃有________________种;其中两种
的结构简式是: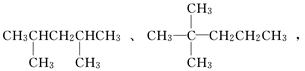 试写出其他几种
试写出其他几种
分子的结构简式,并用系统命名法命名.
________________________________________________________________________
________________________________________________________________________.
(2)以上分子中有一种分子是由烯烃加成得到,而且分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称________________________________________________.