将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液。下列说法中正确的是
| A.若c1 = 2c2,则w1<2w2,V<50 mL | B.若c1 = 2c2,则w1<2w2,V>50 mL |
| C.若w1 = 2w2,则c1<2c2,V="50" mL | D.若w1 = 2w2,则c1>2c2,V<50 mL |
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是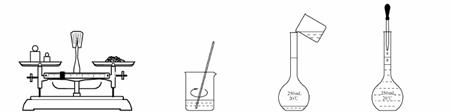
| A.称量 | B.溶解 | C.转移 | D.定容 |
分类是学习化学的重要方法.下列归纳正确的是
| A.SO2、SiO2、CO均为酸性氧化物 | B.纯碱、烧碱、熟石灰都属于碱类 |
| C.氨气、冰醋酸、食盐均为电解质 | D.冰和干冰既是纯净物又是化合物 |
下列试剂的贮存方法不正确的是
| A.钠保存在煤油中 | B.盛放NaOH溶液时,使用带玻璃塞的试剂瓶 |
| C.在存放液溴的试剂瓶中应加水封 | D.保存氯化亚铁溶液时,要加入少量的铁粉 |
下列说法正确的是
| A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B.石英只能用于生产光导纤维 |
| C.“盐卤点豆腐”利用了胶体的性质 |
| D.CO2、NO2、SO2都会导致酸雨的形成 |
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2 |