(12分)实验室配制460mL0.100mol/LNa2CO3溶液回答下列问题,现有下列仪器
A 烧杯 B 100mL量筒 C 100mL容量瓶 D 药匙 E.玻璃棒 F.托盘天平
(1)配制时,必须使用的仪器有___________(填代号),还缺少的仪器是_______________。该试验中两次用到玻璃棒,其作用分别是___________________,_________________。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为_________,若加蒸馏水不慎超过刻度线,处理的方法是______________。
(3)若实验遇下列情况,溶液的浓度偏高的是 ( )
A 溶解后没有冷却便进行定容
B 摇匀后发现液面低于刻度线,滴加蒸馏水至刻度线再摇匀
C 定容时俯视容量瓶的刻度线
D.容量瓶内壁附有水珠而未干燥处理
F.称取的Na2CO3·10H2O晶体失去了部分结晶水
(4)若取50.0mL上述已配好的溶液,与另一150mL0.200mol/L的Na2CO3溶液混合,最后得到的溶液的物质的量浓度为_________________(设溶液的体积变化可忽略)。
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为;
(2)反应开始至5min Z的平均反应速率为, X的转化率为;
(3)5min后Z的生成速率比5min末Z的生成速率大、小、相等)。
处于相邻2个周期的主族元素A、B、C、D。它们原子半径依次减小。A离子和B离子的电子层相差2层,且能形成BA2型的离子化合物。C的离子带3个单位正电荷。D的气态氢化物通式为H2R,在其最高价氧化物中D质量分数为40%。D的原子序数大致等于其原子量数值的一半。试回答
①A是______ B是______ C是______ D是______(填元素符号)
②B、C、D单质的还原性从大到小的顺序是___________。
③向D的氢化物的水溶液中,滴入少量A单质的水溶液,写出反应方程式_____________________________________。
下表是周期表中的一部分,根据元素A—I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
Bm] |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,氧化性最强的单质是, (2)最高价氧化物的水化物碱性最强的是,酸性最强的是;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是;
(4)在B、C、D、E、F、G、H中,原子半径最大的是.
离子半径最大的是.写出AEH形成的一种盐(化肥)的电子式.
.有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(一)苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被卤素原子取代;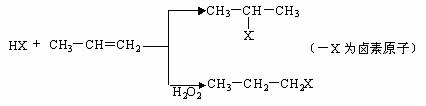
(二)工业上利用上述信息,按下列路线合成结构简式为的物质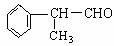 ,该物质是氢化阿托醛一种香料。
,该物质是氢化阿托醛一种香料。
请根据上述路线,回答下列问题:
(1)A为一氯代物,它的结构简式可能为_______________________________________。
(2)工业生产过程中,中间产物必须经过②③④得到D,而不采取直接转化为D的方法原因是_____________________________________。
(3)写出反应类型②_________、③_________。
(4)反应④的化学方程式为:__________________________________________。
(5)氢化阿托醛与氢气1:1加成后的产物C9H10O的同分异构体很多,写出两种符合下列三个条件的 C9H10O的同分异构体的结构简式:__________________、___________________。
①能与溴水反应
②能与氢氧化钠溶液反应
③分子中只有苯环一种环状结构,苯环上有两个取代基,且苯环上的一溴代物有两种;
(6)氢化阿托醛发生银镜反应的化学方程式为_____________________________________。
(12分)据《中国制药》报道,化合物F是用于制备“非典”药品(盐酸祛炎痛)的中间产物,其合成路线为:
已知:(Ⅰ)RNH2+R/CH2Cl  RNHCH2 R/+HCl(R和R/代表烃基)
RNHCH2 R/+HCl(R和R/代表烃基)
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:
(Ⅲ)
(苯胺,弱碱性,易氧化)
(Ⅳ) 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物。
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物。
回答下列问题:
(1)反应①的条件是_______________________________
(2)反应③和反应④的顺序不能颠倒,原因是_____________________________________
(3)C的结构简式是_________________。
(4)D+E→F的化学方程式:_____________________。
(5)反应①~⑤中,属于取代反应的是(填反应序号)_______________ 。