(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液。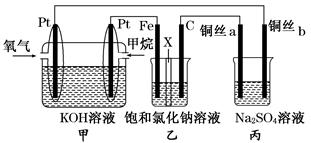
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是: 。
(2)石墨电极(C)的电极反应式为______________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为___ L。
(4)铜丝a处在开始一段时间的现象为______________;原因是________________________________________________________________________。
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为____________________________。
A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体。
(1)写出E元素的名称: E________
(2)画出C原子的原子结构示意图,写出AB2的结构式
(3)写出DB2使澄清石灰水变浑浊的化学方程式:_____________________
(4)写出E的单质与NaOH溶液反应的离子方程式:________________________________________
(共8分)用下列:①H2O②H2O2③Ba(OH)2④Na2O2⑤Cl2⑥Ar⑦CO2等物质填空。 (1—4小题填序号)
(1) 由离子键和非极性键构成的是
(2) 由极性键和非极性键构成的是
(3) 不存在化学键的是
(4) 共价化合物有
(5) 写出下列物质的电子式:Na2O2
下列反应属于放热反应的是属于吸热反应的是(填字母)
| A.铝片与稀H2SO4反应制取H2 | B.碳酸钙高温分解成氧化钙和二氧化碳 |
| C.葡萄糖在人体内氧化分解 | D.氢氧化钾和硫酸中和 |
E.Ba(OH)2·8H2O与NH4Cl反应
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象是__________________________
(2)产生上述现象的原因是_______________;
(3)写出有关的离子方程式:_______________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
在一块大理石(主要成分是CaCO3)上,先后滴加1mol/LHCl溶液和0.1mol/LHCl溶液反应快的是_________________,先后滴加同浓度的热盐酸和冷盐酸,反应快的是____,用大理石块和大理石粉分别跟同浓度的盐酸起反应,反应快的是。