运用化学反应原理研究元素及其化合物的反应有重要意义。
工业合成氨过程中,N2和H2反应生成NH3:N2(g)+3H2(g)  2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2NH3(g)。混合体系中NH3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: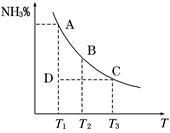
(1)N2(g)+3H2(g)  2NH3(g)的ΔH________0(填“>”或“<”)。
2NH3(g)的ΔH________0(填“>”或“<”)。
(2)若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不移动”) 。
(3)若温度为T1时,反应进行到状态D时,v正_____v逆(填“>”、“<”或“=”)。
(4)在体积为5 L的恒温、恒容密闭容器中,起始时投入2 mol N2、3 mol H2,经过10 s达到平衡,测得平衡时NH3的物质的量为0.8 mol。
①达平衡时N2的转化率=________。
②容器中反应的逆反应速率随时间变化的关系如图。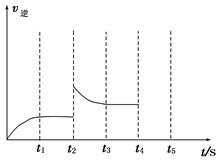
t2时改变了某一种条件,改变的条件可能是__________、____________________(填写两项)。
自来水厂需对原水经过除去固体杂质和悬浮物、消毒、除去异味等一系列净化程序后才能使其成为生活、生产用水。说明在该过程中加入下列物质的化学式、目的及所利用的原理。
(1)明矾:化学式为,目的,原理;
(2)臭氧:化学式为,目的,原理;
酸雨给人类带来种种危害,严重威胁着生态环境。结合所学的化学知识,回答下列问题:
(1)称为酸雨的水溶液的pH范围是______ ___;
A. pH<7 B. pH<5.6 C. pH>5.6 D. pH<0
(2)下列气体过量排放,不会形成酸雨的是______;
A.二氧化碳 B.二氧化硫 C.二氧化氮 D.氯化氢
(3)请举出一例酸雨的危害。
人们生活中使用的化纤地毯、三合板、油漆等化工产品,会释放出某种污染空气的气体A。为使衣服达到防皱、改善手感等效果,在制作过程中也添加A。但衣服中残留的A超标会危害人体健康。A的化学式为,是一种色、有刺激性气味,溶于水, ________毒的气体;新买的衣服若有刺激性气味,有可能是A含量超标,所以,买回服装后应先用水洗,以去掉残留的A。
目前地球环境污染问题越来越严重,如温室效应、臭氧层破坏、光化学烟雾事件、酸雨的形成、有毒物质的污染等已成为世界各国普遍关注和研究的问题。请回答:
(1)产生酸雨的原因主要是大气中含有大量的(填序号,下同)。
A.SO2 B.NO2 C.CO2 D.CO
(2)臭氧层的破坏导致紫外线对地球表面辐射的增加,从而使全球皮肤癌的发病率明显增加。造成这一现象的主要原因是。
A.人们大量使用了氟氯烃
B.人们在炼钢时向空气中排放了大量高炉煤气
C.石油炼制厂排放了大量甲烷、氢气
D.硝酸、硫酸工厂排放了大量的二氧化碳和一氧化氮
(3)在上世纪60年代,一些工业发达国家的城市都相继发生过光化学烟雾事件,并造成数以千计的人员伤亡,光化学烟雾事件产生的主要原因是。
A.汽油的不完全燃烧
B.大量使用了化肥和农药
C.白色塑料垃圾的漂浮
D.金属矿物的冶炼
(4)为了减少大气中二氧化碳的含量,下列措施可行的是。
A.改进能源结构 B.提高能源利用率
C.大量使用化石燃料 D.提倡植树种草
(11分) 铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
(1)钴原子的基态电子排布式为_____________________ _____________。
(2)金属铬的堆积方式属于A2型,其晶胞示意图为________(填序号)。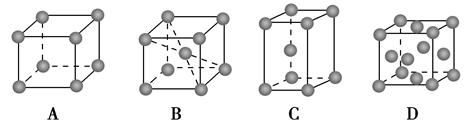

(3)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5 ℃,沸点117 ℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态CrO2Cl2属于________晶体;
②丙酮中碳原子采取的杂化方式为___;
③CS2属于________(填“极性”或“非极性”)分子。
(4)+3价铬的配合物K[Cr(C2O4)2(H2O)2]中,配体是________________,与C2O42—互为等电子体的分子是(填化学式)________。
(5)CrCl3·6H2O(相对分子质量为266.5)有三种不同颜色的异构体:[Cr(H2O)6]Cl3、[Cr(H2O)5Cl]Cl2·H2O和[Cr(H2O)4Cl2]Cl·2H2O。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665 g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435 g。该异构体为____________________(填化学式)。